化学反応と分子
すべての元素は、その最外殻がオクテット則に従って電子で満たされているときに最も安定します。これは、原子がそのような配置にあることがエネルギー的に有利であり、安定しているからです。しかし、すべての元素が最外殻を満たすだけの電子を持っているわけではないので、原子は他の原子と化学結合して、安定した電子配置になるために必要な電子を得ます。2つ以上の原子が化学的に結合すると、その化学構造は分子になります。身近な水分子であるH₂Oは、2つの水素原子と1つの酸素原子から構成されています。図2.9に示すように、この2つの原子が結合することで水が形成されます。原子は、その外殻を満たす電子を提供したり、受け入れたり、共有したりすることで、分子を形成することができるのです。
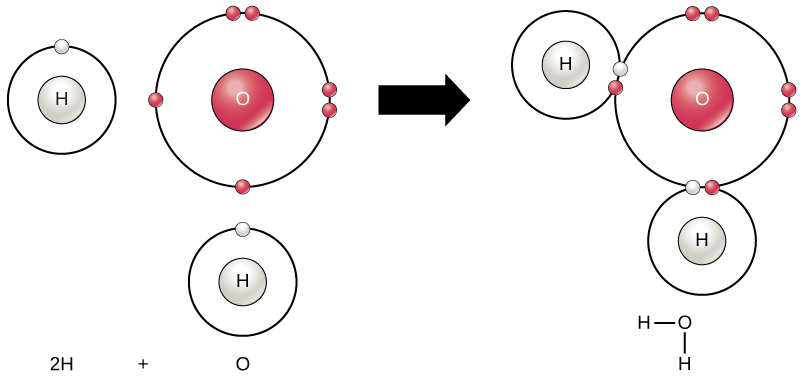
化学反応は、2つ以上の原子が結合して分子を形成したり、結合した原子が分解することで起こります。科学者は、化学反応の最初に使われる物質を反応物(通常、化学式の左側)と呼び、反応終了時の物質を生成物(通常、化学式の右側)と呼びます。通常、反応物と生成物の間には、化学反応の方向を示す矢印を描きます。この方向は必ずしも「一方通行」ではありません。上記の水分子を作るには、化学式は次のようになります。
$$\mathrm{2H + O → H₂O}$$
単純な化学反応の例としては、2つの水素原子が2つの酸素原子と結合した過酸化水素分子(H₂O₂)を分解することが挙げられます。反応物である過酸化水素は、2個の水素原子に1個の酸素原子が結合した水(H₂O)と、2個の酸素原子が結合した酸素(O₂)に分解されます。下の式では、反応には2つの過酸化水素分子と2つの水分子が含まれています。これは化学方程式の例で、各元素の原子数が方程式の両側で同じになっています。質量保存の法則によれば、化学反応の前後で原子の数は等しくなるはずであり、通常であれば原子の生成や破壊は起こらないはずです。
$$\mathrm{2H₂O₂(過酸化水素)→2H₂O(水)+O₂(酸素)}$$
この反応の反応物と生成物はすべて分子(各原子は他の少なくとも1つの原子と結合している)であるにもかかわらず、この反応では化合物(2種類以上の元素の原子を含む)は過酸化水素と水だけです。酸素分子は、図2.10に示すように、二重に結合した2つの酸素原子から構成されており、化合物には分類されず、等核の分子に分類されます。
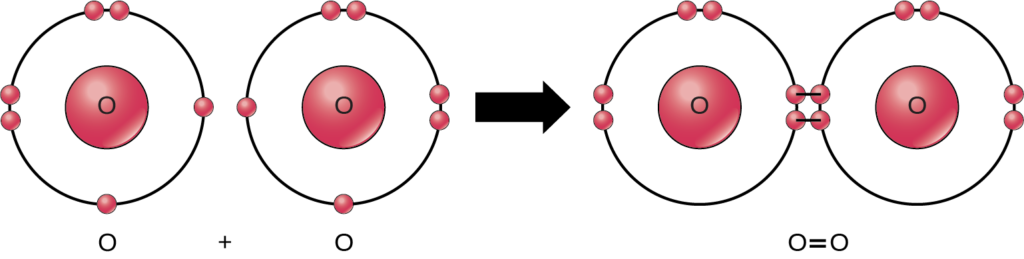
上の例のように、化学反応の中には、すべての反応物を消費するまで一方向に進むものがあります。このような反応を表す方程式には一方向の矢印が含まれており、不可逆的です。可逆反応は、どちらの方向にも進むことができる反応です。可逆反応では、反応物が生成物に変わりますが、生成物の濃度が一定の閾値(反応によって異なる)を超えると、これらの生成物の一部が反応物に戻ります。この時点で、生成物と反応物の表記が逆転するのです。この行き来は、反応物と生成物の相対的なバランスが取れるまで続き、これを平衡と呼びます。このような可逆反応の状態を表すには、化学式に両矢印を反応物と生成物の両方に向けて書きます。
例えば、人間の血液中では、余分な水素イオン(H⁺)が重炭酸イオン(HCO₃⁻)と結合して、炭酸(H₂CO₃)と平衡状態になっています。このシステムに炭酸を加えると、その一部が重炭酸イオンと水素イオンに変換されます。
$$\mathrm{HCO₃⁻+ H⁺↔H₂CO₃}$$
しかし、生体反応では、反応物または生成物、あるいはその両方の濃度が常に変化し、ある反応の生成物が別の反応の反応物となることが多いため、平衡状態になることはほとんどありません。血液中の余分な水素イオンの例で言えば、炭酸を生成することが反応の主要な方向ではありますが、炭酸は重炭酸イオンに戻らずに炭酸ガスとして体外に排出されることもあるため、質量作用の法則により反応は右方向に進むことになります。こうした反応は、私たちの血液のホメオスタシスを維持するために重要です。
$$\mathrm{HCO₃⁻ + H⁺ ↔ H₂CO₃ ↔ CO₂ + H₂O}$$
イオンとイオン結合
原子の中には、電子を1個(場合によっては2個)得たり失ったりしてイオンを形成すると、より安定するものがあります。イオンになることで、原子の一番外側の電子殻が満たされ、エネルギー的に安定するのです。電子の数と陽子の数が一致しないので、各イオンは正味の電荷を持っています。陽イオン(カチオン)は、電子を失って形成される、正の電荷をもったイオンです。負の電荷をもったイオンは電子を得ることで形成されますが、これを陰イオン(アニオン)と呼びます。陰イオンは、元素名の末尾を「-ide」に変えて表記し、塩素chlorineの陰イオンは塩化物chloride、硫黄sulfurの陰イオンは硫化物sulfideとなります。
科学者たちは、ある元素から別の元素へと電子が移動することを電子移動と呼んでいます。図2.11に示すように、ナトリウム(Na)は外殻に電子を1個しか持っていません。ナトリウムが1つの電子を提供するのに必要なエネルギーは、外殻を埋めるために7つの電子を受け入れるのに必要なエネルギーよりも少なくて済みます。ナトリウムが電子を失うと、陽子が11個、中性子が11個、電子が10個となり、全体として+1の電荷を持つことになります。これをナトリウムイオンと呼びます。最もエネルギーの低い状態(基底状態と呼ばれる)の塩素(Cl)は、外殻に7個の電子を持っています。繰り返しになりますが、塩素は7個の電子を失うよりも1個の電子を得た方がエネルギー効率が良いのです。そのため、塩素は電子を1個獲得して、陽子17個、中性子17個、電子18個のイオンを作り、正味の負(-1)の電荷をもつ傾向があります。このイオンを塩化物イオンと呼びます。この例では、ナトリウムが1個の電子を提供して殻を空にし、塩素が電子を受け取って殻を埋めることになります。これで、どちらのイオンもオクテット則を満たし、最外殻が完成しました。電子の数が陽子の数と等しくなくなったため、それぞれがイオンとなり、+1(ナトリウムカチオン)または-1(塩化物アニオン)の電荷を持つことになります。ナトリウム原子が電子を失うためには、塩素原子のような適切な受け手の存在が必要なのです。
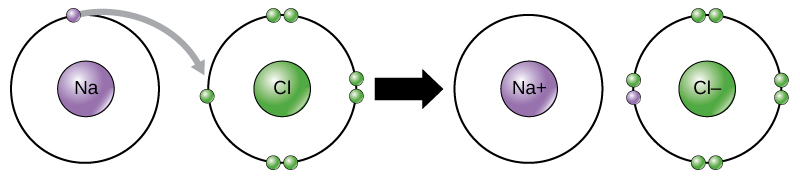
イオン結合は、反対の電荷を持つイオン間で形成されます。例えば、正の電荷を持つナトリウムイオンと負の電荷を持つ塩化物イオンが結合して塩化ナトリウムの結晶(食卓塩)を作ると、正味の電荷がゼロの結晶分子ができます。
生理学者は、ある種の塩を電解質(ナトリウム、カリウム、カルシウムなど)と呼んでおり、これらは神経の伝達、筋肉の収縮、水分バランスなどに必要なイオンです。スポーツドリンクや栄養補助食品の多くは、運動時の発汗によって失われたイオンを補うために、これらのイオンを供給しています。
共有結合とその他の結合・相互作用
オクテット則を満たすもう一つの方法は、原子間で電子を共有して共有結合を形成することです。共有結合は、イオン結合よりも強く、生物の分子内では非常に一般的な結合です。共有結合は、DNAやタンパク質などの有機分子によく見られます。また、H₂O、CO₂、O₂などの無機分子にも共有結合が存在します。共有結合には、1対の電子を共有するもの、2対の電子を共有するもの、3対の電子を共有するものがあり、それぞれ単結合、二重結合、三重結合となっています。2つの原子間の共有結合が多ければ多いほど、その結合は強くなります。したがって、三重結合は最も強い結合です。
大気中に最も多く存在する気体は窒素(N₂)であるにもかかわらず、生物が分子を構成するための窒素を手に入れるのが難しい主な理由の一つは、共有結合の強さの違いにあります。窒素分子は、2つの窒素原子が三重に結合したもので、他の分子と同様に、この3対の電子を2つの窒素原子で共有することで、それぞれの外殻を満たすことができ、個々の窒素原子よりも安定した分子になります。この強い三重結合があるために、生体がこの窒素を分解してタンパク質やDNAの構成要素にすることが困難なのです。
水分子の形成は、共有結合の一例です。図2.9に示すように、共有結合は、水の分子を形成する水素原子と酸素原子を結合します。水素の電子は、水素原子の不完全な外殻と、酸素原子の不完全な外殻の間を行き来します。6個の電子を持つ酸素の外殻を完全に満たすためには、2個の電子(水素原子から1個ずつ)が必要であり、そのためにH₂Oというよく知られた化学式が成り立ちます。このように、2つの元素はそれぞれの外殻を埋めるための電子を共有しているため、2つの元素は単独でいるより安定しています。
動画で学習
イオン結合と共有結合のアニメーション
極性共有結合
共有結合には、極性と非極性の2種類があります。極性共有結合では、図2.12に示すように、原子が不均等に電子を共有しており、電子が一方の原子核にもう一方の原子核よりも強く引きつけられています。異なる元素の原子間では、電子の配分が不均等であるため、わずかに正(δ+)または負(δ-)の電荷が発生します。この部分電荷は水の重要な性質であり、水の特徴の多くを説明するものです。
水は極性分子であり、水素原子は部分的に正電荷を、酸素は部分的に負電荷を帯びます。これは、酸素原子の原子核が水素原子の電子を引きつける力が、水素原子の原子核が酸素原子の電子を引きつける力よりも大きいために起こります。したがって、酸素は水素よりも電気陰性度が高く、共有された電子は水素原子の原子核よりも酸素原子の原子核の近くにいる時間が長いため、酸素原子はわずかに負の電荷を、水素原子は正の電荷を持つのです。別の言い方をすれば、酸素原子核の近くに共有電子がある確率は、水素原子核の近くにある確率よりも高いということになります。いずれにしても、原子の相対的な電気陰性度は、一方の元素が他方の元素よりも明らかに電気陰性度が高いときに部分電荷を発生させます。この極性結合が発生させる電荷を利用して、水素結合を形成することができます(後述する水素結合は、わずかに正電荷を帯びた水素原子と、わずかに負電荷を帯びた他の分子の原子との間の弱い結合である)。高分子には電気陰性度の異なる原子が含まれていることが多いため、有機分子には極性結合が多く存在します。
非極性共有結合
非極性共有結合は、同じ元素の2つの原子間や、電子を均等に共有する異なる元素間で形成されます。例えば、酸素分子(O₂)は、2つの酸素原子の間で電子が均等に分配されているため、非極性です。
また、図2.12には、非極性共有結合の例として、メタン(CH₄)を示しています。炭素は、最外殻に4個の電子を持っているため、これを埋めるためにはさらに4個の電子が必要です。この4個の電子を4個の水素原子からそれぞれ1個ずつ得て、安定した8個の外殻を作ります。炭素と水素の電気陰性度は同じではありませんが、似ているため、非極性の結合が形成されます。水素原子はそれぞれ1個の電子を必要とし、2個の電子を含むと最外殻が満たされます。これらの元素は、炭素原子と水素原子の間で電子を均等に共有し、非極性共有結合分子を作ります。
水素結合とファンデルワールス相互作用
元素間のイオン結合と共有結合は、切断するのにエネルギーを必要とします。イオン結合は共有結合ほど強くないため、生体内での挙動を左右します。しかし、すべての結合がイオン結合や共有結合であるわけではありません。分子間には弱い結合も形成されます。弱い結合としては、水素結合とファンデルワールス相互作用がよく知られています。この2種類の結合がなければ、私たちの生活は成り立ちません。水素結合は、水の生命維持に重要な特性の多くを提供し、細胞の構成要素であるタンパク質やDNAの構造を安定させています。
水素を含む極性共有結合が形成されると、水素の電子が他方の元素の方に強く引っ張られ、水素から離れるため、結合中の水素はわずかに正の電荷を持ちます。水素はわずかに正の電荷を持つと、隣り合う負の電荷に引き寄せられます。このとき、ある分子の水素のδ+と、より電気陰性度の高い原子(通常は酸素)を持つ別の分子のδ-電荷との間に弱い相互作用が生じます。科学者はこの相互作用を水素結合と呼んでいます。このタイプの結合は一般的で、水分子の間で定期的に発生します。個々の水素結合は弱く、簡単に切れてしまいますが、水や有機ポリマー中には非常に多く存在し、結合の大きな力となっています。水素結合は、DNAの二重らせんを束ねる役割も果たしています。
ファンデルワールス相互作用は、水素結合と同様に、分子間の弱い引力や相互作用です。ファンデルワールスの引力は、2つ以上の分子の間で発生し、原子の周りで常に対称ではない電子密度のわずかな変動に依存しています。このような引力が発生するためには、分子同士が非常に接近している必要があります。これらの結合は、イオン結合、共有結合、水素結合とともに、タンパク質が細胞内で正しく機能するために必要な三次元構造に寄与しています。
創薬化学者
創薬化学者は、新薬の開発や、古い薬と新しい薬の作用機序の解明を担当し、薬剤開発過程のあらゆる段階に関わります。薬は、自然環境の中で見つけることも、実験室で合成することもできます。多くの場合、化学者は自然界にある潜在的な薬物を実験室で化学的に変化させ、より安全で効果的なものにします。また、自然界で見つけた薬物を合成品で代用することもあります。
最初の発見または合成の後、化学者は薬を開発し、場合によっては化学的に変化させ、毒性があるかどうかをテストし、効率的な大量生産のための方法を設計します。その後、医薬品として承認されるまでのプロセスが始まります。アメリカでは、FDA(Food and Drug Administration)が薬の承認を行っています。このプロセスでは、人を対象とした大規模な実験を繰り返し、薬が有害ではなく、目的とする症状を効果的に治療できることを確認します。このプロセスには、化学者だけでなく、医師や科学者も参加し、数年をかけて試験を行い、承認を得ます。
生体内から発見された薬剤の例としては、乳がんの治療に用いられる抗がん剤のパクリタキセル(タキソール)があります。この薬はイチイの樹皮から発見されました。また、ヤナギの樹皮から分離されたアスピリンもその一例です。薬を見つけるためには、何百もの植物、菌類、その他の生物のサンプルを調べ、生物学的に活性な化合物が含まれているかどうかを確認する必要があります。
伝統的な医学は、現代の医学に活性化合物を発見するためのヒントを与えてくれることがあります。例えば、柳の皮は古代エジプト時代から何千年にもわたって人類が薬として利用してきました。しかし、科学者や製薬会社がアスピリンの分子(アセチルサリチル酸)を精製し、人間用に販売したのは1800年代後半のことです。
ある用途のために開発された薬が、予期せぬ効果を発揮して、関連性のない別の用途に使われることもあります。例えば、ミノキシジル(ロゲイン)は、高血圧の治療薬として開発されました。人体実験を行ったところ、この薬を服用した人に新しい髪が生えてくることがわかりました。最終的に製薬会社は、失われた髪を回復させるために、この薬を脱毛症の男性と女性に販売しました。
最後に、 創薬化学者 は負の効果、あるいは効果がないことを発見することがあります。1960年代初頭、発明家や医師、さらには米国の上院議員までもが、新薬「クレビオゼン」に抗がん作用があると主張し、積極的に販売を開始しました。しかし、FDAの化学者であるアルマ・レバント・ヘイデンとそのチームは、赤外分光分析の過程で、この「奇跡の薬」がクレアチンという一般的な化合物に過ぎないことを発見したのです。
創薬化学者は、人類の健康に貢献することを目的として、研究、実験、薬の開発などを行っているのです。




コメント