3.4 タンパク質
このセクションを読み終える頃には、あなたは次のことができるようになるでしょう。
- タンパク質が細胞や組織で果たしている多様な機能を説明できる。
- アミノ酸がタンパク質の構成要素であることを理解し、その関係について議論できる。
- タンパク質が持つ4段階の構造レベルについて説明できる。
- タンパク質の形(構造)と機能が密接に関連していることを説明できる。
タンパク質 (protein) は、生命システムの中で最も豊富に存在する有機分子の一つであり、すべての高分子の中で最も多様な範囲の機能を持っています。タンパク質は、体を形作る構造材になったり、体の機能を調節したり、筋肉のように収縮したり、あるいは体を守ったりする役割を果たします。また、物質の輸送、貯蔵、細胞膜の構成要素としても機能し、時には毒素や酵素 (enzyme)(化学反応を助ける触媒)として働くこともあります。
生命システムの中の各細胞には、それぞれが固有の機能を持つ何千ものタンパク質が含まれている可能性があります。その構造も、機能と同様に非常に多様です。しかし、驚くべきことに、これらすべてのタンパク質は、アミノ酸 (amino acid) と呼ばれる基本的な構成要素が、直線状の鎖のように連なってできたポリマーなのです。
タンパク質の種類と機能
細胞が生み出す酵素は、生化学反応(例えば消化)における触媒であり、通常は複雑なタンパク質、あるいは他の分子と結合した複合タンパク質です。それぞれの酵素は、それが作用する特定の基質 (substrate)(酵素に結合する反応物)に対して特異性を持っています。酵素は、基質の分解、分子内の原子の再配置、あるいは新しい分子の合成といった反応を助けます。基質を分解する酵素を異化酵素 (catabolic enzyme)、基質からより複雑な分子を合成する酵素を同化酵素 (anabolic enzyme)、そして反応速度に影響を与える酵素を触媒酵素 (catalytic enzyme) と呼びます。ここで大切なのは、すべての酵素は反応速度を高めるため、有機触媒 (organic catalyst) であるということです。酵素の一例として、唾液に含まれるアミラーゼがあります。これは、デンプンの成分であるアミロースという基質を加水分解(水を使って分解)する働きをします。
ホルモン (hormone) は、通常は小さなタンパク質またはステロイドからなる化学的な信号伝達分子です。これらは内分泌細胞 (endocrine cell) によって分泌され、成長、発生、代謝、生殖など、特定の生理学的プロセスを制御または調節するために働きます。例えば、インスリンは血糖値を調節するのを助けるタンパク質ホルモンです。表3.1は、タンパク質の主な種類と機能を示しています。
表3.1 タンパク質の種類と機能
| 種類 | 例 | 機能 |
|---|---|---|
| 消化酵素 | アミラーゼ、リパーゼ、ペプシン、トリプシン | 栄養素をモノマー単位に分解(異化)することで食物の消化を助ける |
| 輸送タンパク質 | ヘモグロビン、アルブミン | 血液やリンパ液に乗って体中に物質を運ぶ |
| 構造タンパク質 | アクチン、チューブリン、ケラチン | 細胞骨格など、さまざまな構造物を構築する |
| ホルモン | インスリン、サイロキシン | 体のさまざまなシステムの活動を調整する |
| 防御タンパク質 | 免疫グロブリン | 体を外部からの病原体から守る |
| 収縮タンパク質 | アクチン、ミオシン | 筋肉の収縮を引き起こす |
| 貯蔵タンパク質 | マメ科植物貯蔵タンパク質、卵白(アルブミン) | 発生初期の胚や種子の発芽に必要な栄養を提供する |
タンパク質はさまざまな形と分子量(分子の大きさや重さの指標)を持っています。球状の形をしたタンパク質もあれば、繊維状の性質を持つタンパク質もあります。例えば、血液中で酸素を運ぶヘモグロビンは球状タンパク質ですが、私たちの皮膚に存在するコラーゲンは繊維状タンパク質です。タンパク質の形はその機能にとって極めて重要であり、多くの異なる種類の化学結合がこの形を維持しています。温度やpH(酸性・アルカリ性の度合い)の変化、あるいは特定の化学物質にさらされることによって、タンパク質の形が永続的に変化し、その結果、機能を失ってしまうことがあります。この現象を変性 (denaturation) と呼びます。驚くべきことに、これほど多様なタンパク質も、すべて同じ20種類の基本的なアミノ酸が、さまざまな順序と数で組み合わさってできているのです。(最近、セレノシステインとピロリジンという2つの珍しいアミノ酸が発見され、将来的にはさらに新しいものがリストに加わるかもしれません。)
アミノ酸
アミノ酸は、タンパク質を構成するモノマー(基本的な構成単位)です。それぞれのアミノ酸は、共通の基本構造を持っています。それは、中心にある炭素原子(アルファ炭素 (alpha (α) carbon) と呼ばれます)に、アミノ基 (amino group) (-NH$_2$)、カルボキシル基 (carboxyl group) (-COOH)、そして一つの水素原子(-H)が結合したものです。さらに、すべてのアミノ酸には、この中心炭素に結合した、もう一つの原子または原子団があり、これをR基 (R group) または側鎖 (side chain) と呼びます(図3.22)。
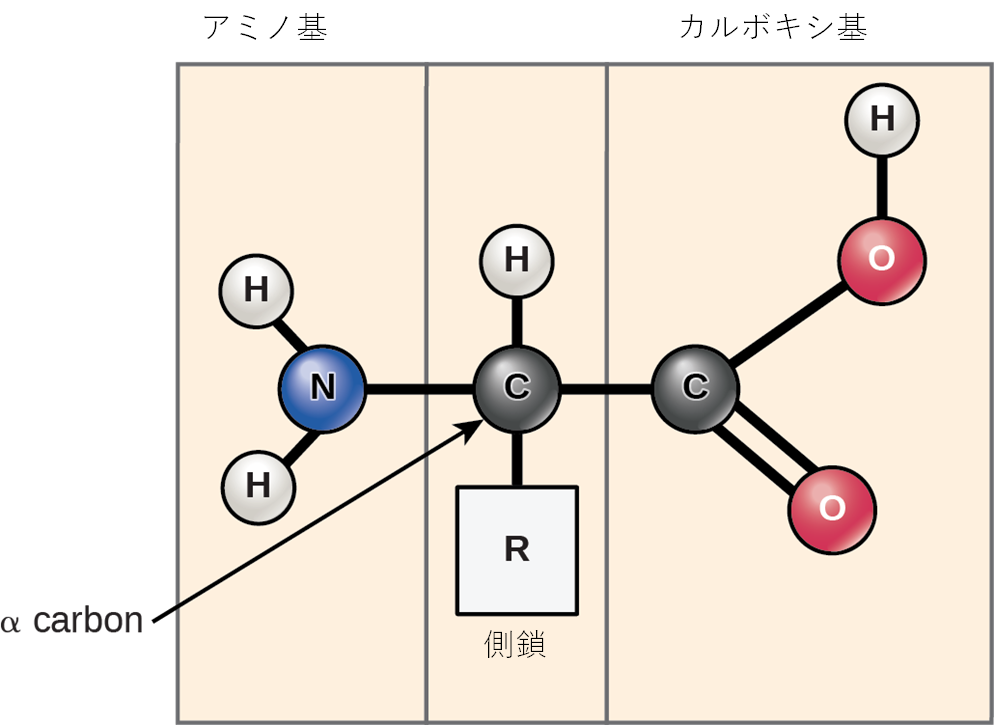
「アミノ酸」という名前は、これらの分子がその基本構造の中にアミノ基とカルボキシル基(酸性を示す基)の両方を含んでいることから名付けられました。すでにお話ししたように、タンパク質中には一般的に20種類のアミノ酸が存在します。このうち9種類は、人間の体内で合成することができず、食事から摂取する必要があるため、必須アミノ酸 (essential amino acid) と呼ばれています。それぞれのアミノ酸で異なるのが、R基(側鎖)です(図3.23)。
図を見て考えよう 3.23
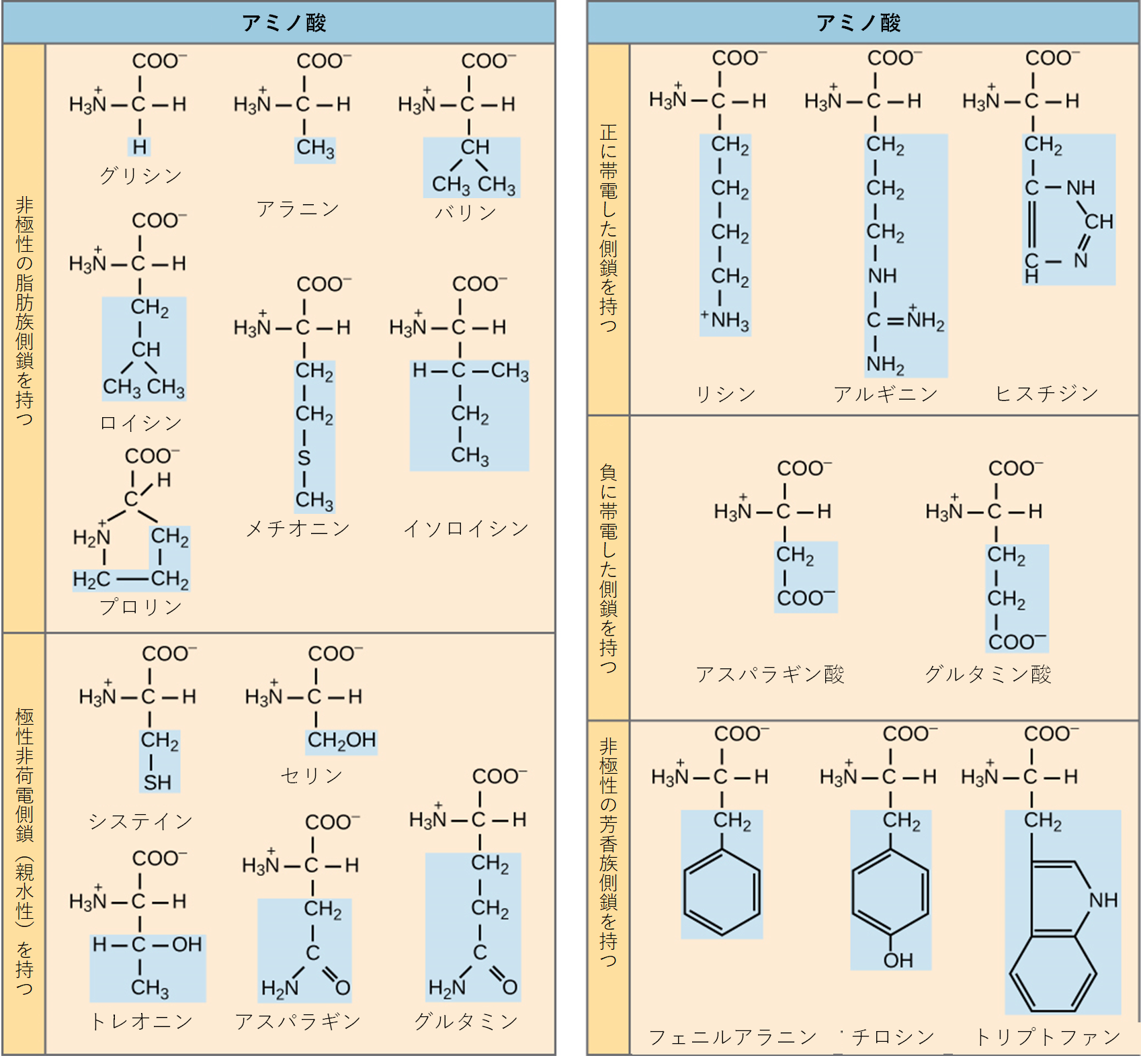
水に溶けやすいタンパク質の表面には、どのような性質(カテゴリー)のアミノ酸が多く存在すると考えられますか?また、タンパク質の内部にはどのような性質のアミノ酸が多いでしょうか?細胞膜のような脂質の二重層に埋め込まれたタンパク質では、アミノ酸はどのように分布していると予想されますか
(解答は3.4節末に記載)
このR基(側鎖)の化学的な性質が、そのアミノ酸の全体的な性質(例えば、酸性か塩基性か、極性 (polar)(水になじみやすいか)か非極性 (nonpolar)(水になじみにくいか))を決定します。例えば、最も単純なアミノ酸であるグリシンは、R基として水素原子を持っています。バリン、メチオニン、アラニンのようなアミノ酸は、非極性、つまり疎水性 (hydrophobic)(水を嫌う性質)です。一方、セリン、スレオニン、システインのようなアミノ酸は極性を持ち、親水性 (hydrophilic)(水に親和性のある性質)の側鎖を持っています。リジンやアルギニンの側鎖は正の電荷を帯びているため、これらは塩基性アミノ酸でもあります。プロリンは少し特殊で、R基がアミノ基と結合して環のような構造を形成しています。そのため、プロリンはアミノ基が側鎖から独立していないという点で、標準的なアミノ酸構造の例外となります(図3.23参照)。
アミノ酸は、単一の大文字(例:V)または3文字の略語(例:Val)で表されます。これはバリンの場合です。必須脂肪酸と同様に、いくつかのアミノ酸も食事にとって不可欠です。人間におけるこれらの必須アミノ酸には、イソロイシン、ロイシン、システインなどがあります。必須アミノ酸とは、体内でタンパク質を作るために必要ですが、体内で合成できないものを指します。どのアミノ酸が必須であるかは、生物種によって異なります。
最終的にタンパク質の形、大きさ、そして機能を決定するのは、アミノ酸がどのような順序で、いくつ連なっているか、ということです。アミノ酸同士は、ペプチド結合 (peptide bond) と呼ばれる共有結合によって連結されます。この結合は、脱水反応によって形成されます。具体的には、一方のアミノ酸のカルボキシル基(-COOH)ともう一方のアミノ酸のアミノ基(-NH$_2$)が反応し、水分子(H$_2$O)が一つ失われることで形成されます。こうしてできた結合がペプチド結合です(図3.24)。
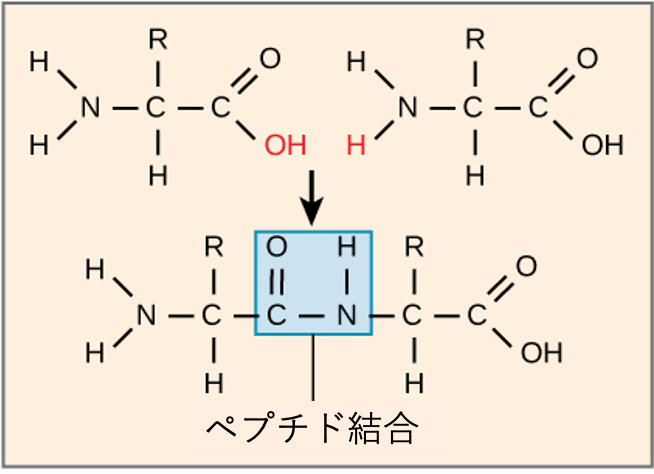
このような結合によって形成される生成物をペプチドと呼びます。アミノ酸がこの成長していく鎖にさらに結合していくと、結果としてできる鎖をポリペプチド (polypeptide) と呼びます。各ポリペプチド鎖には、一方の端にフリーな(他の結合に関与していない)アミノ基があります。この端をN末端 (N terminal) またはアミノ末端と呼びます。もう一方の端にはフリーなカルボキシル基があり、これをC末端 (C terminal) またはカルボキシル末端と呼びます。「ポリペプチド」と「タンパク質」という言葉は時々同じ意味で使われますが、厳密には、ポリペプチドはアミノ酸のポリマー(重合体)であり、「タンパク質」という用語は、一つまたは複数のポリペプチドが組み合わさり、しばしばペプチド以外の補欠分子族(タンパク質の機能に必要な非アミノ酸部分)が結合し、特定の独特な形を持ち、固有の機能を持つものを指すために使われます。タンパク質合成(翻訳 (translation))の後、ほとんどのタンパク質は修飾を受けます。これらは翻訳後修飾 (post-translational modification) として知られています。タンパク質は切断されたり、リン酸基が付加(リン酸化)されたり、他の化学基の付加が必要となる場合があります。これらの修飾が行われて初めて、タンパク質は完全に機能できるようになるのです。
学びへのリンク
このインタラクティブなチュートリアルでタンパク質合成のステップをクリックして進んでください。
進化のつながり
シトクロムcの進化的意義
シトクロムcは、細胞呼吸の一部である電子伝達系 (electron transport chain) の重要な構成要素であり、通常、細胞小器官であるミトコンドリアに存在します。このタンパク質はヘム (heme) という補欠分子族を持ち、ヘムの中心にある鉄イオンは、電子伝達の間に交互に還元(電子を受け取る)されたり酸化(電子を失う)されたりします。細胞のエネルギー生産におけるこの必須タンパク質の役割は極めて重要であるため、数百万年という長い年月を経ても、その構造はほとんど変化していません。タンパク質のアミノ酸配列決定 (protein sequencing) により、異なる生物種間でシトクロムcのアミノ酸配列にかなりの類似性(相同性 (homology))があることが示されています。言い換えれば、さまざまな生物種のDNAやタンパク質の配列間の類似性や相違点を測定することによって、進化的な類縁関係を評価することができるのです。
科学者たちは、ヒトのシトクロムcが104個のアミノ酸からなることを突き止めました。これまでに配列決定されたさまざまな生物由来のシトクロムc分子において、これらのアミノ酸のうち37個は、すべてのシトクロムcサンプルで同じ位置に見られます。これは、これらの生物が共通の祖先を持っていた可能性を示唆しています。ヒトとチンパンジーのタンパク質配列を比較すると、配列の違いは見つかりませんでした。研究者がヒトとアカゲザルの配列を比較したところ、たった一つのアミノ酸に違いがあるだけでした。別の比較では、ヒトと酵母の配列決定では、44番目の位置に違いが見られます。これらの比較は、生物間の進化的な距離を分子レベルで測る手がかりを与えてくれます。
タンパク質の構造
これまで見てきたように、タンパク質の「形」はその機能にとって決定的に重要です。例えば、酵素は特定の形をした「活性部位」と呼ばれる場所で、特定の基質(反応する相手の分子)と結合します。もし、温度変化や化学的な影響でこの活性部位の形が変わったり、タンパク質全体の構造が変わってしまったりすると、酵素はもはや基質と結合できなくなるかもしれません。
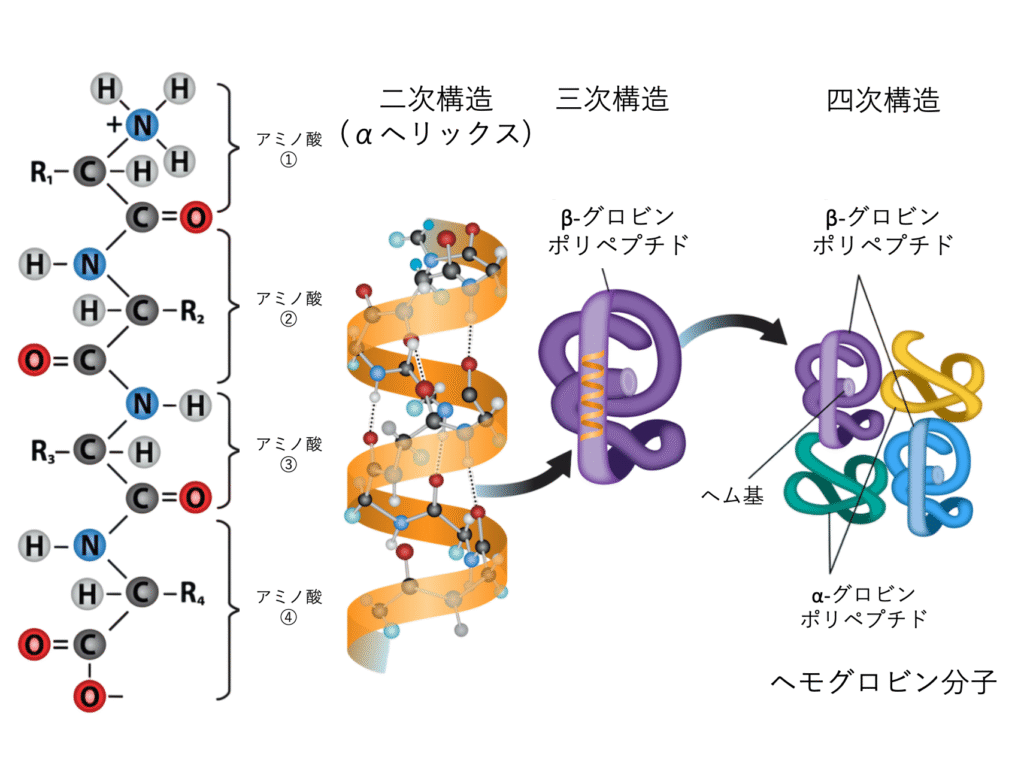
タンパク質が最終的にどのような形(立体構造またはコンフォメーション)になるのかを理解するためには、タンパク質の構造に見られる4つの段階的なレベル、すなわち一次構造 (primary structure)、二次構造 (secondary structure)、三次構造 (tertiary structure)、そして四次構造 (quaternary structure) を理解する必要があります。
一次構造
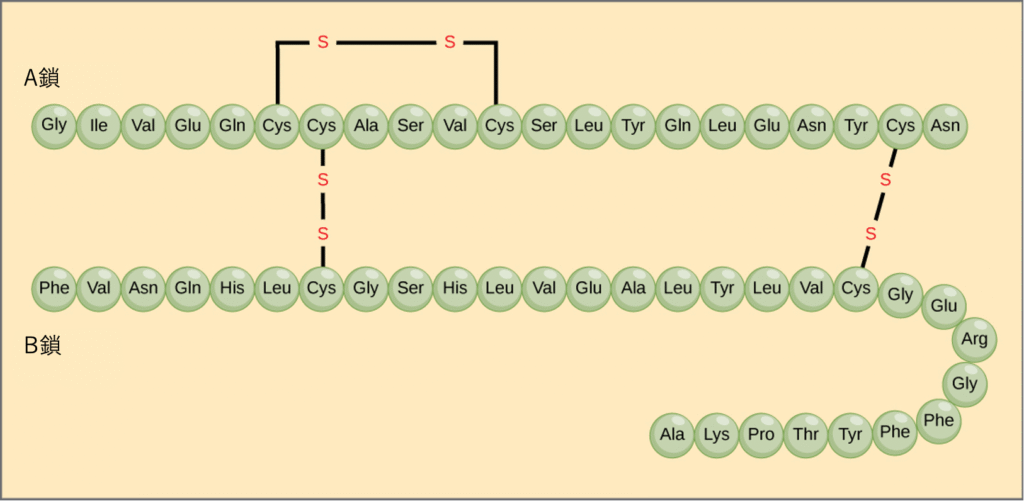
ポリペプチド鎖におけるアミノ酸のユニークな並び順、これがタンパク質の一次構造です。まるで、さまざまな色のビーズを一列に並べるように、どのアミノ酸がどの順番で繋がっているかを示します。例えば、膵臓から分泌されるホルモンであるインスリンは、A鎖とB鎖という2本のポリペプチド鎖からなり、それらはジスルフィド結合 (disulfide bond)(硫黄原子間の強い結合)によって繋がっています。A鎖のN末端(アミノ基側)のアミノ酸はグリシンであり、C末端(カルボキシル基側)のアミノ酸はアスパラギンです(図3.25)。A鎖とB鎖のアミノ酸配列は、インスリンというタンパク質に固有のものです。
すべてのタンパク質のユニークな一次構造(アミノ酸配列)は、最終的にはそのタンパク質の設計図である遺伝子によって決定されます。遺伝子のタンパク質をコードしている領域のヌクレオチド(DNAの構成要素)配列に変化が生じると、ポリペプチド鎖が作られる際に異なるアミノ酸が組み込まれてしまう可能性があり、これがタンパク質の構造と機能の変化を引き起こすことがあります。鎌状赤血球貧血 (sickle cell anemia) という病気では、ヘモグロビン(血液中で酸素を運ぶタンパク質)のβ鎖(図3.26にその一部を示します)において、たった一つのアミノ酸が置き換わっています。具体的には、グルタミン酸というアミノ酸の代わりにバリンというアミノ酸が入ってしまうのです。このわずかな違いが、タンパク質全体の構造と機能に劇的な変化を引き起こします。
ここで最も驚くべきことは、ヘモグロビン分子が約150個のアミノ酸からなるα鎖2本とβ鎖2本で構成されていることです。つまり、ヘモグロビン分子全体では約600個のアミノ酸が含まれています。しかし、正常なヘモグロビン分子と、患者さんの寿命を著しく縮めてしまう鎌状赤血球分子との構造的な違いは、この600個のアミノ酸のうち、たった一つなのです。さらに驚くべきことに、これらのアミノ酸はそれぞれ3つのヌクレオチドによってコードされており、この病気を引き起こす突然変異は、わずか1つの塩基(DNAの文字)の変化、つまり1800塩基のうちのたった1つの変化によって起こるのです。
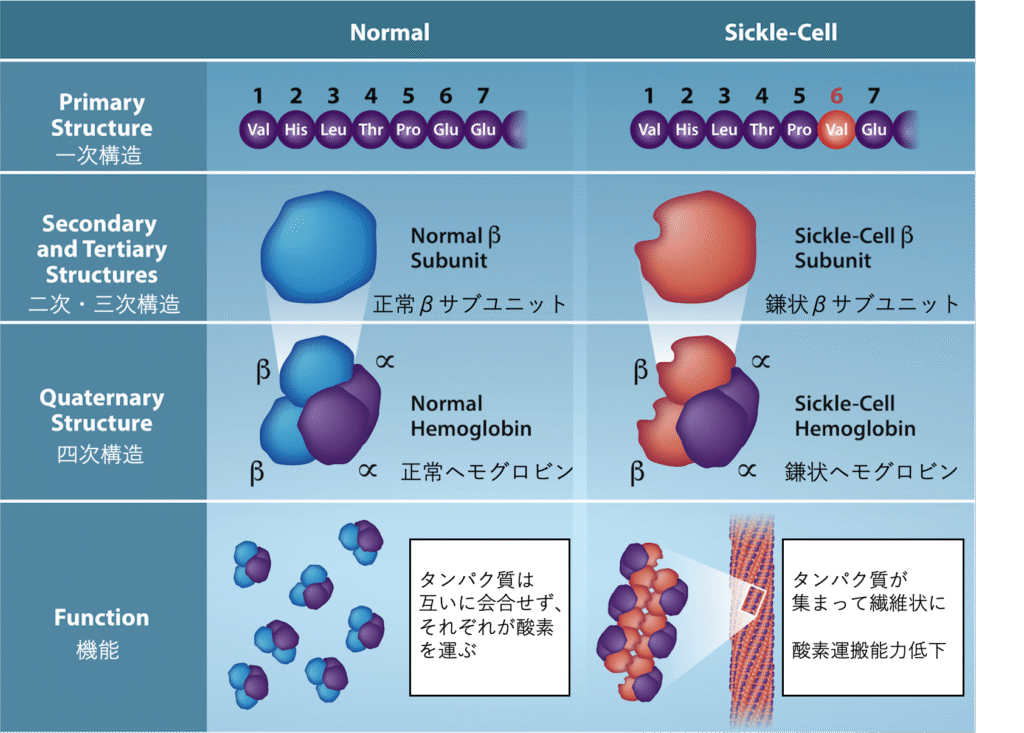
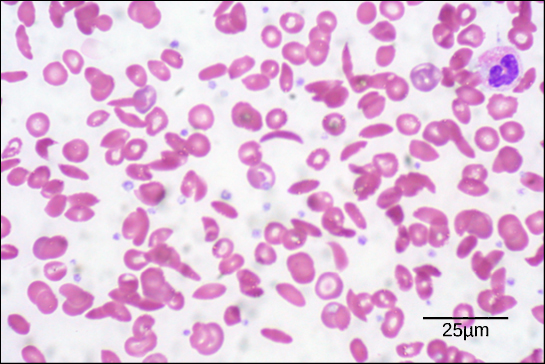
このたった一つのアミノ酸の変化によって、ヘモグロビン分子は異常に長い繊維状の構造を形成するようになります。これが、本来は円盤状である赤血球を歪ませ、三日月形、いわゆる「鎌状」の形に変えてしまい、細い血管を詰まらせる原因となります(図3.27)。この血管の詰まりが、息切れ、めまい、頭痛、腹痛など、この病気に罹患している人々が経験する、多くの深刻な健康問題につながるのです。
二次構造
ポリペプチド鎖のある部分が、規則的に折り畳まれたり、らせん状になったりして形成される局所的な構造が、タンパク質の二次構造です。最もよく見られる二次構造には、α-ヘリックス (alpha-helix) とβ-プリーツシート (beta-pleated sheet) があります(図3.28)。これらの構造はどちらも、ポリペプチド鎖の主鎖(アミノ酸が連なった骨格部分)にある原子間で形成される水素結合 (hydrogen bond)(比較的弱い化学結合)によって、その特定の形が保たれています。具体的には、あるアミノ酸のカルボニル基(C=O)の酸素原子と、そこから鎖に沿って4つ離れた位置にある別のアミノ酸のアミノ基(N-H)の水素原子との間で水素結合が形成されるのです。
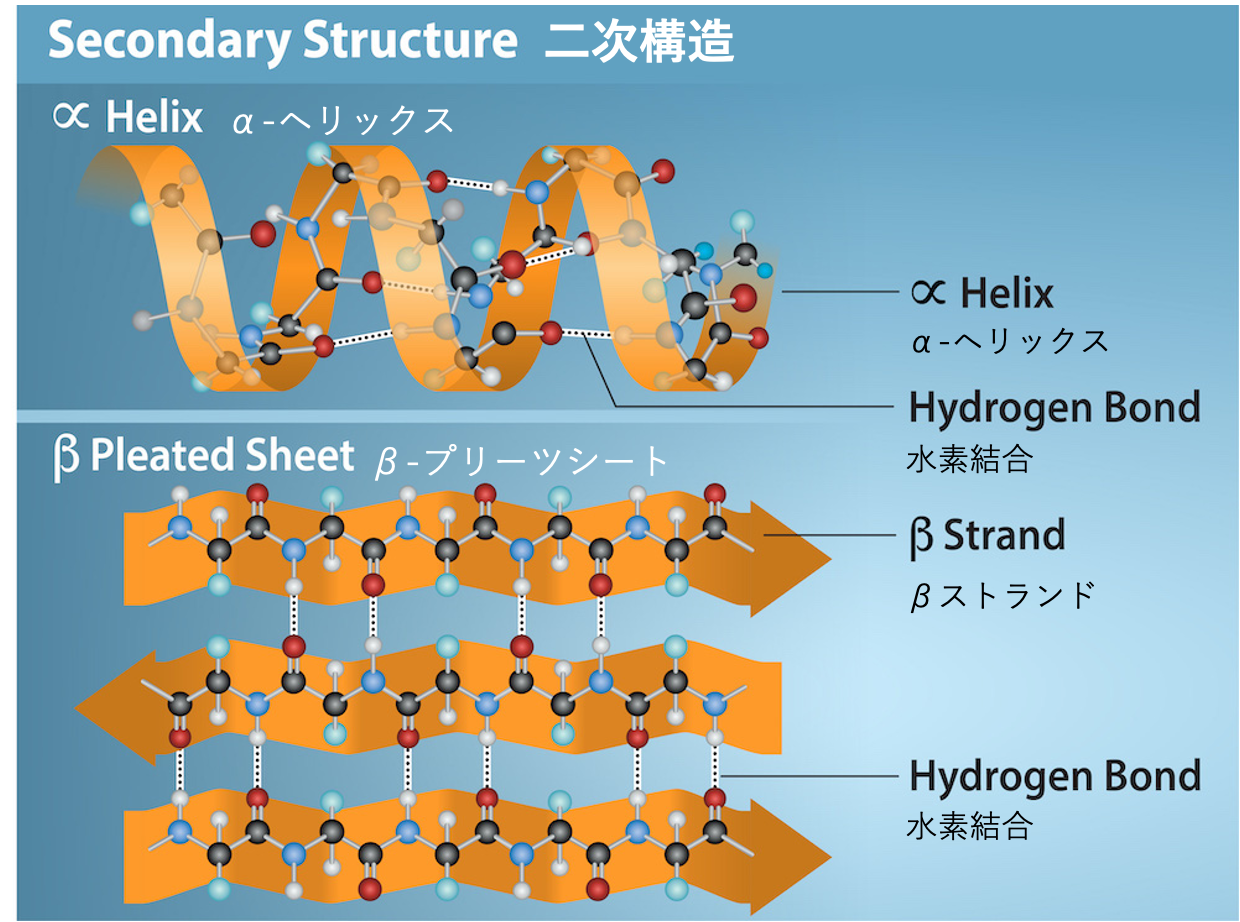
α-ヘリックス構造では、ポリペプチド鎖が右巻きのらせんを形成し、1回のらせんターンあたりに約3.6個のアミノ酸が含まれます。アミノ酸のR基(側鎖)は、このらせんの外側に向かって突き出ています。一方、β-プリーツシート構造では、ポリペプチド鎖がジグザグに折り畳まれ、まるで屏風(びょうぶ)のようなシート状の構造を作ります。このシート構造も、鎖の骨格部分にある原子間の水素結合によって安定化されています。R基は、このプリーツ(折り目)の上下に突き出すように配置されます。複数のβ-プリーツシートが平行または逆平行(互いに逆向き)に並び、シート間で水素結合が形成されることで、より大きな構造が作られることもあります。α-ヘリックスとβ-プリーツシートは、球状タンパク質(球形に近いタンパク質)や繊維状タンパク質(細長い形のタンパク質)の多くに見られ、タンパク質全体の形を決定する上で重要な構造的役割を果たしています。
三次構造
一本のポリペプチド鎖が、二次構造(α-ヘリックスやβ-プリーツシート)を形成しながら、さらに全体として複雑に折り畳まれてできあがる、ユニークな三次元構造。これがタンパク質の三次構造です(図3.29)。この複雑な形は、主にポリペプチド鎖にぶら下がっている様々なR基(側鎖) の間の化学的な相互作用によって決まります。
二次構造を安定させている水素結合だけでなく、R基同士の間にも様々な力が働きます。例えば、異なるアミノ酸のR基が持つ性質(親水性か疎水性か、電荷を帯びているかなど)によって、相互作用の仕方が変わります。水になじみにくい疎水性のR基を持つアミノ酸は、水を避けるようにタンパク質の内部に集まろうとします(これを疎水性相互作用 (hydrophobic interaction) と呼びます)。逆に、水になじみやすい親水性のR基は、タンパク質の表面に出て水と接しようとします。また、正の電荷を持つR基と負の電荷を持つR基は、互いに引き合いイオン結合 (ionic bond) を形成します。同じ電荷を持つR基同士は反発します。さらに、特定のR基(例えば、システインの持つ-SH基)同士は、酸素が存在する条件下でジスルフィド結合 (disulfide bond) という強い共有結合を形成することもあります。これはタンパク質の折り畳み過程で形成される唯一の共有結合です。
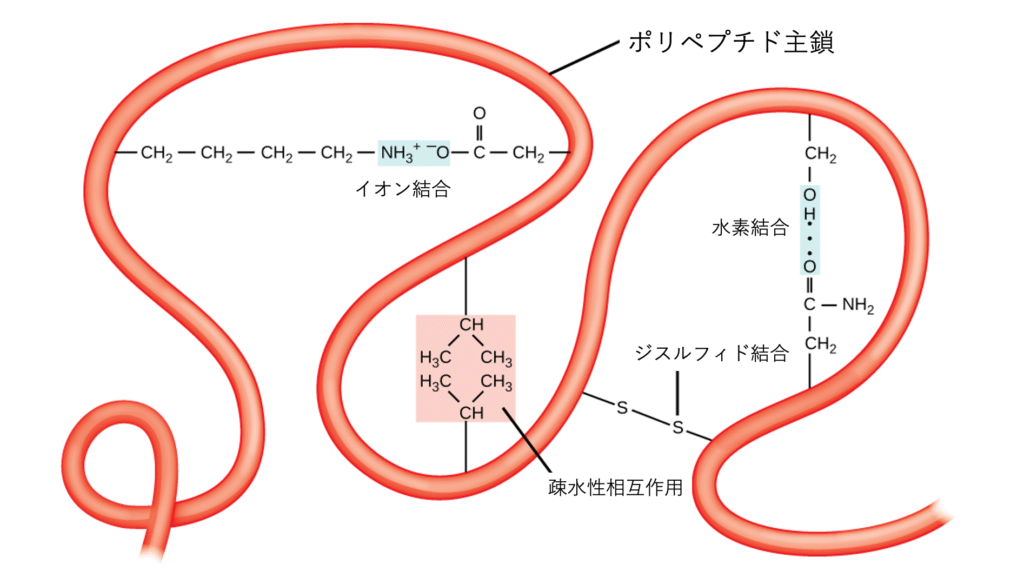
このように、水素結合、疎水性相互作用、イオン結合、ジスルフィド結合といった、弱い力から強い力までの様々な相互作用が複雑に絡み合い、それぞれのタンパク質に固有の、最終的な三次元形状(三次構造)を決定しているのです。そして、もしタンパク質がこの正しい三次元形状を失ってしまうと、多くの場合、その機能を果たせなくなってしまいます。
四次構造
自然界には、一本のポリペプチド鎖だけでなく、複数本のポリペプチド鎖(これらをサブユニット (subunit) と呼びます)が集まって一つの機能的なタンパク質を形成しているものがあります。これらのサブユニット同士が相互作用し、組み合わさってできあがる全体の構造が、タンパク質の四次構造です。サブユニット間の弱い相互作用(水素結合やイオン結合、疎水性相互作用など)が、この複合体全体の構造を安定させるのに役立っています。
例えば、インスリン(球状タンパク質)は、元々は一本のポリペプチド鎖として作られますが、その後、翻訳後修飾によって一部が切り取られ、残った二本の鎖(A鎖とB鎖)がジスルフィド結合で繋がれます。この二本の鎖がさらに水素結合などで相互作用し、全体として球状の形をとります(これはインスリン二量体などの四次構造を形成する例です)。一方、絹(シルク、繊維状タンパク質)は、複数のポリペプチド鎖がβ-プリーツシート構造をとり、それらが水素結合によって互いに結びついてシート状の構造を作っています。これも四次構造の一例と言えます。
図3.30は、タンパク質構造のこれら4つのレベル(一次、二次、三次、四次)をまとめて示しています。
変性とタンパク質の折りたたみ
それぞれのタンパク質は、固有のアミノ酸配列(一次構造)を持ち、それに基づいて決まるユニークな三次元形状(二次、三次、四次構造)をしています。この形は、様々な化学的相互作用によって維持されています。しかし、タンパク質が温度やpH(酸性度)の急激な変化にさらされたり、特定の化学物質に触れたりすると、これらの相互作用が壊れてしまい、一次構造(アミノ酸の並び順)は保たれたままでも、その固有の三次元形状が失われてしまうことがあります。この現象を変性 (denaturation) と呼びます。
多くの場合、変性は可逆的です。つまり、変性を引き起こした原因(例えば高温や極端なpH)が取り除かれれば、一次構造は保たれているため、タンパク質は再び正しい形に折り畳まれ、その機能を取り戻すことができます。しかし、場合によっては変性は不可逆的、つまり元の形には戻れなくなり、永久に機能を失ってしまうこともあります。身近な例としては、生卵を焼くと卵白(主成分はアルブミンというタンパク質)が固まる現象があります。これは熱によってアルブミンが不可逆的に変性するためです。
ただし、すべてのタンパク質が高温で変性するわけではありません。例えば、温泉のような高温環境で生きる細菌は、沸点に近い温度でも機能できる特殊なタンパク質を持っています。また、私たちの胃の中は非常に強い酸性(低pH)ですが、そこで働く消化酵素は、この過酷な環境下でも変性せずに活性を保っています。
タンパク質が正しく機能するためには、そのアミノ酸鎖が正確な三次元構造に折り畳まれること(タンパク質の折りたたみ (protein folding))が極めて重要です。かつて科学者たちは、タンパク質自身がその情報に基づいて自発的に正しい形に折り畳まれると考えていました。しかし、近年の研究により、多くの場合、タンパク質が折り畳まれる過程で、「シャペロン (chaperone)」またはシャペロニンと呼ばれる、タンパク質の「折りたたみのお手伝いさん」の助けを借りていることがわかってきました。シャペロンは、折り畳み途中のタンパク質に一時的に結合し、不適切な凝集(タンパク質同士がくっついてしまうこと)を防ぎ、正しい折り畳みを助けます。そして、ターゲットとなるタンパク質が正しく折り畳まれると、シャペロンはそのタンパク質から離れていきます。
学びへのリンク
タンパク質に関する追加の視点については、このアニメーション「生体分子:タンパク質」をご覧ください。
3.4 節末の演習解答
図を見て考えよう 3.23 解答
- 可溶性タンパク質の表面: 水と相互作用しやすい親水性アミノ酸(極性荷電(酸性および塩基性)および極性非荷電)が見られると予想されます。これらは水分子と水素結合などを形成できます。
- 可溶性タンパク質の内部: 水から隠れる傾向がある疎水性アミノ酸(非極性)が見られると予想されます。これらは互いに相互作用してタンパク質のコアを形成します。
- 脂質二重層に埋め込まれたタンパク質:
- 膜貫通領域(脂質二重層内部): 脂質二重層の疎水性コアと相互作用するため、非極性(疎水性)アミノ酸が多く存在すると予想されます。
- 細胞質側および細胞外側に露出した領域: 水と相互作用するため、親水性アミノ酸(極性荷電および極性非荷電)が多く存在すると予想されます。
3.4 Glossary
- Amino acid: アミノ酸
- Alpha-helix (α-helix): アルファヘリックス
- Alpha-carbon (α-carbon): アルファ炭素
- Amino group: アミノ基
- Anabolic enzyme: 同化酵素
- Beta-pleated sheet (β-pleated sheet): ベータプリーツシート
- Carboxyl group: カルボキシル基
- Catabolic enzyme: 異化酵素
- Catalytic enzyme: 触媒酵素
- Chaperone (chaperonin): シャペロン (シャペロニン)
- Denaturation: 変性
- Disulfide bond: ジスルフィド結合
- Electron transport chain: 電子伝達系
- Endocrine cell: 内分泌細胞
- Enzyme: 酵素
- Essential amino acid: 必須アミノ酸
- Heme: ヘム
- Homology: 相同性
- Hormone: ホルモン
- Hydrophilic: 親水性
- Hydrophobic: 疎水性
- Hydrophobic interaction: 疎水性相互作用
- Ionic bond: イオン結合
- N terminal: N末端
- C terminal: C末端
- Nonpolar: 非極性
- Organic catalyst: 有機触媒
- Peptide bond: ペプチド結合
- Polar: 極性
- Polypeptide: ポリペプチド
- Post-translational modification: 翻訳後修飾
- Primary structure: 一次構造
- Protein: タンパク質
- Protein folding: タンパク質の折りたたみ
- Protein sequencing: アミノ酸配列決定
- Quaternary structure: 四次構造
- R group (side chain): R基 (側鎖)
- Secondary structure: 二次構造
- Sickle cell anemia: 鎌状赤血球貧血
- Substrate: 基質
- Subunit: サブユニット
- Tertiary structure: 三次構造
- Translation: 翻訳





コメント