学習目標
このセクションを終える頃には、以下のことができるようになっています。
- 炭素が生命にとって重要である理由を説明することができる
- 生体分子における官能基の役割を説明することができる
細胞を構成するのは、タンパク質、核酸(RNAやDNA)、炭水化物、脂質などの高分子と呼ばれる複雑な分子です。こうした高分子は、有機分子(炭素を含む液体、固体、気体のこと)の一部であり、生命にとって特に重要なものです。こうした高分子を構成する基本要素は炭素です。炭素原子は、4つの異なる原子と共有結合を形成できるというユニークな性質を持っており、高分子の基本的な構造要素である「骨格」として理想的な元素なのです。
炭素原子は、最外殻の電子が不完全です。原子番号6(電子6個、陽子6個)の炭素原子は、最初の2個の電子が内殻を満たし、残りの4個の電子が第2殻を満たします。したがって、炭素原子は他の原子と最大4つの共有結合を形成することで、オクテット則を満たすことができる。メタン分子がその例です。メタンの化学式はCH₄であり、4個の水素原子はそれぞれ1個の電子を共有して炭素原子と共有結合を形成しています。これにより、最外殻が満たされているのです。
炭化水素
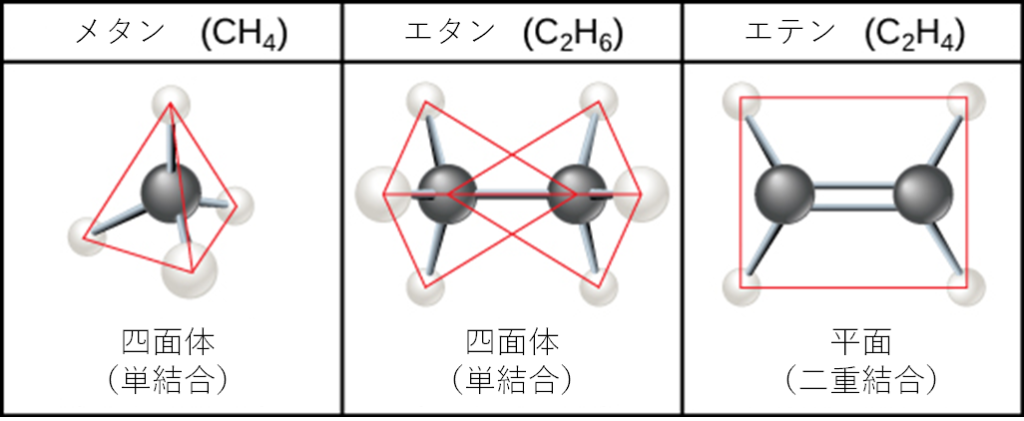
炭化水素とは、炭素と水素だけで構成される有機分子のことで、前述のメタン(CH₄)などがこれにあたります。炭化水素は、ガスグリルのプロパン(C3H8)やライターのブタン(C4H10)のように、私たちの生活の中で燃料として使われることが多くあります。炭化水素は、原子間の多くの共有結合によって大きなエネルギーを蓄えており、そのエネルギーは分子が燃焼(酸化)する際に放出されます。優れた燃料であるメタンは、最も単純な炭化水素分子で、図2.21に示すように、中心の炭素原子が4つの異なる水素原子と結合しています。その電子軌道の形状が、メタン分子の幾何学的形状(原子が3次元的に存在する形状)を決定します。炭素と4つの水素原子は、4つの三角形の面を持つ正四面体を形成しています。そのため、メタンは四面体の形状をしていると表現されます。
生物の大きな分子の骨格となる炭化水素は、直線的な炭素鎖、環状に結合した炭素環、またはその両方の組み合わせとして存在します。さらに、個々の炭素間の結合は、単結合、二重結合、三重結合のいずれかであり、それぞれの結合が分子の形状に特定の方法で影響を与えます。こうした3次元的な形状やコンフォメーション(立体構造)が、生命の高分子の機能を左右します。
鎖式炭化水素
炭素原子間の連続した結合は、炭化水素鎖を形成します。炭化水素鎖には、枝分かれしているものとしていないものがあります。さらに、図2.22に示すように、共有結合の一重、二重、三重の形状の違いにより、分子全体の形状が変化します。図2.22に示すように、炭化水素であるエタン、エテン(エチレン)、エチン(アセチレン)は、炭素間結合の違いが分子の形状にどのような影響を与えるかを示す例となります。この3つの分子の名前は、炭素数2の炭化水素を表す接頭辞「eth-」で始まります。接尾辞の「-ane」、「-ene」、「-yne」は、それぞれ炭素-炭素結合が単結合、二重結合、三重結合であることを意味しています。したがって、プロパン、プロペン、プロピンは炭素数3の分子で、ブタン、ブテン、ブチンは炭素数4の分子で、というように、同じパターンをたどることになります。二重結合と三重結合は、分子の形状を変えます。単結合は結合の軸に沿って回転できるが、二重結合は平面的な構成に、三重結合は直線的な構成になるのです。これらの幾何学的形状は、特定の分子が取り得る形状に大きな影響を与えます。
環式炭化水素
これまで説明してきた炭化水素は、炭素原子が直鎖状に連なった脂肪族炭化水素でした。もう1つの炭化水素である芳香族炭化水素は、単結合と二重結合が交互に並んだ炭素原子の環で構成されています。芳香族炭化水素には環構造が見られ、時には二重結合が存在することもあります。これは、図2.23のシクロヘキサンの構造とベンゼンを比較することでわかります。ベンゼン環を持つ生体分子の例としては、一部のアミノ酸、コレステロールやその誘導体、ホルモンのエストロゲンやテストステロンなどがあります。また、除草剤の2,4-Dにもベンゼン環が含まれています。ベンゼンは原油に含まれる天然成分で、発がん性物質に分類されています。炭化水素の中には、脂肪族と芳香族の両方の部分を持つものがあります。β-カロテンはそのような炭化水素の一例です。
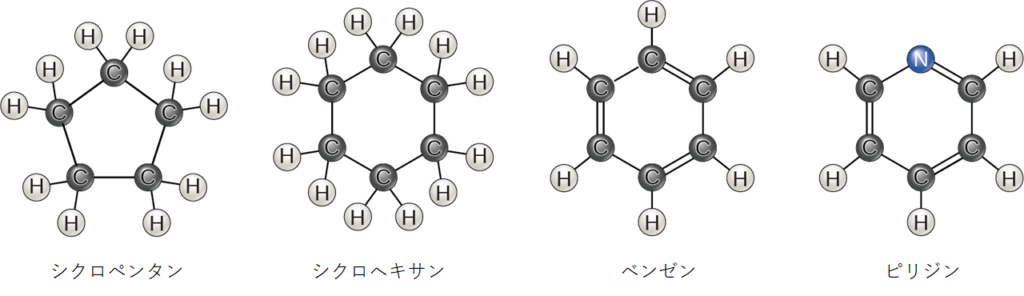
また、炭素の代わりに窒素が入っていることもあり、単結合や二重結合で結ばれている。
異性体
有機分子内の原子や化学結合の3次元的な配置は、その化学的性質を理解する上で重要なものです。化学式が同じでも、原子や化学結合の配置(構造)が異なる分子を異性体と呼びます。図2.24aのブタンとイソブタンのような構造異性体は、共有結合の配置が異なります。どちらの分子も炭素が4個、水素が10個(C₄H₁₀)ですが、分子内の原子配置が異なるため、化学的性質が異なるのです。例えば、ブタンはライターや松明の燃料として、イソブタンは冷媒やスプレー缶の噴射剤として使用されます。
幾何異性体は、共有結合の位置は似ているが、特に二重結合をする炭素の周囲の原子との結合の仕方が異なる異性体です。単純な分子であるブテン(C₄H₈)では、図2.24bが示すように、2つのメチル基(CH₃)は、分子の中心となる二重共有結合のどちら側にも存在することができます。2つの炭素が二重結合の同じ側に結合している場合、これはシスとなります。炭素が二重結合の反対側に結合している場合は、トランスとなります。トランスでは、炭素は多かれ少なかれ直線的な構造を形成します。一方、シスの炭素は、炭素骨格を曲げる(方向を変える)ことになります。
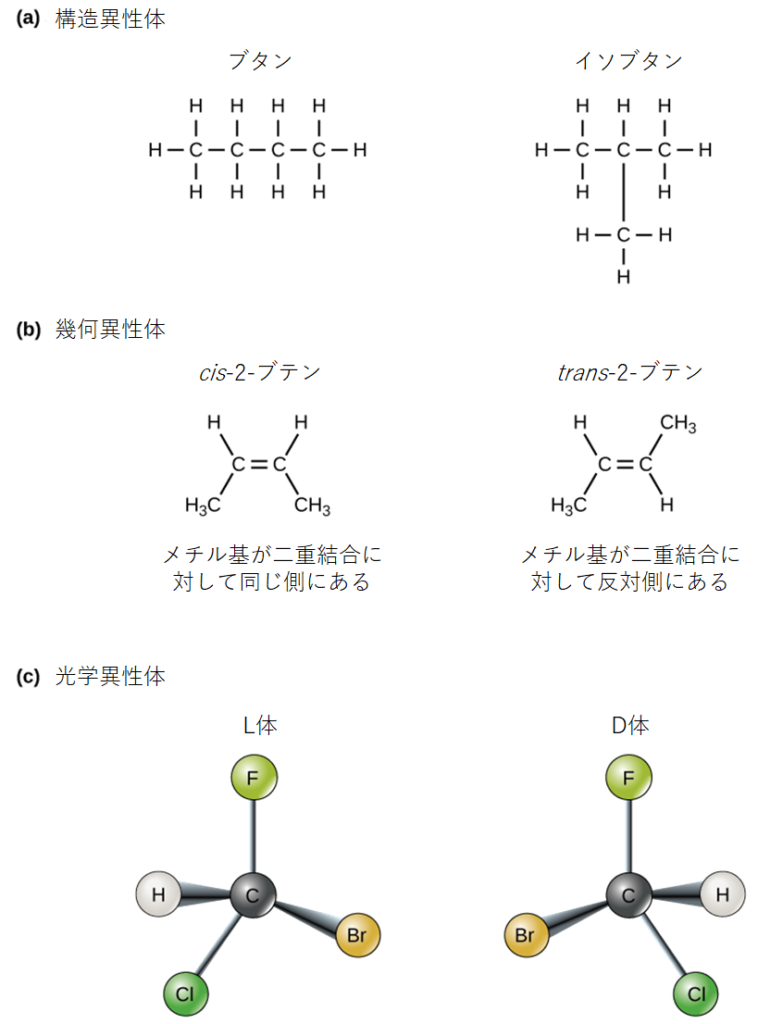
(a)構造異性体は、原子の共有結合の配置が異なる。(b) 幾何異性体は、二重結合の周りの原子の配置が異なる。(c) 光学異性体はお互いの鏡像の関係になっている。
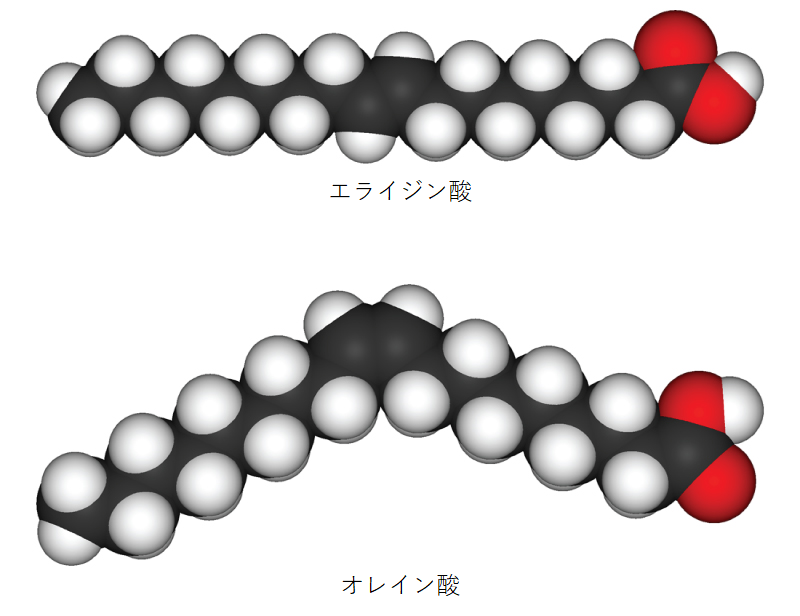
トリグリセリド(脂肪、油)では、図2.25に示すように、脂肪酸と呼ばれる長い炭素鎖に二重結合が含まれることがあり、二重結合にはシス型とトランス型があります。炭素原子間に少なくとも1つの二重結合を持つ脂肪は不飽和脂肪です。二重結合の一部がシス型になっていると、鎖の炭素骨格が曲がってしまうため、トリグリセリドの分子がしっかりと詰まっておらず、室温では液体(油)のままです。一方、トランス型二重結合を持つトリグリセリド(一般にトランス脂肪酸と呼ばれる)は、比較的直線的な脂肪酸を持つため、室温でしっかりと詰まって固体の脂肪を形成することができます。人間の食生活では、トランス脂肪酸は心血管疾患のリスクを高めることが指摘されているため、近年、多くの食品メーカーがその使用を削減または廃止しています。不飽和脂肪とは対照的に、炭素原子間に二重結合を持たないトリグリセリドを、水素原子をすべて含むという意味で飽和脂肪と呼んでいます。飽和脂肪酸は常温では固体であり、通常は動物由来のものです。
光学異性体
光学異性体(エナンチオマー)とは、化学構造や化学結合は同じだが、原子の3次元的な配置が異なるため、重ね合わせることのできない鏡像のような状態になっている分子のことです。図2.26は、アミノ酸のアラニンの例で、2つの構造が重なり合っていないことがわかります。自然界では、タンパク質の中にはL型のアミノ酸が多く含まれています。
バクテリアの細胞壁や他の生物のポリペプチドには、アミノ酸のD型が見られます。同様に、光合成の主な産物であるグルコースはD型であり、L型のものは自然界ではほとんど見られません。
官能基
官能基とは、分子内に存在し、その分子に特定の化学的性質を与える原子のグループです。官能基は、高分子の「炭素骨格」に沿って存在しています。炭素原子の鎖や環に、時おり窒素や酸素などの元素が置換されて、この炭素骨格を形成しています。炭素骨格に他の元素が入っているものは置換炭化水素です。
高分子の官能基は、通常、鎖や環の構造に沿った1つまたは複数の異なる場所で炭素骨格に結合しています。タンパク質、脂質、糖質、核酸の4種類の高分子には、それぞれ特徴的な官能基が存在し、化学的性質の違いや生体内での機能に大きく貢献しています。
官能基は、特定の化学反応に関与することができます。図2.27は、生体分子に含まれる重要な官能基の一部を示しています。ヒドロキシ基、メチル基、カルボニル基、カルボキシ基、アミノ基、リン酸基、スルフヒドリル基などがあります。これらの基は、DNA、タンパク質、炭水化物、脂質などの分子を形成するのに重要な役割を果たしています。通常、官能基はその電荷や極性の特性により、疎水性と親水性に分類されます。疎水性官能基の例としては、非極性のメチル分子が挙げられます。親水性官能基の中には、アミノ酸や一部のアミノ酸側鎖、トリグリセリドやリン脂質を形成する脂肪酸に含まれるカルボキシ基があります。このカルボキシ基がイオン化すると、COOH基から水素イオン(H⁺)が放出され、負の電荷を持つCOO⁻基となります。これは、カルボキシ基が付いている分子の親水性に寄与します。カルボニル基のような他の官能基は、部分的に負に帯電した酸素原子を持ち、水分子と水素結合を形成することがあり、これも分子をより親水性にします。
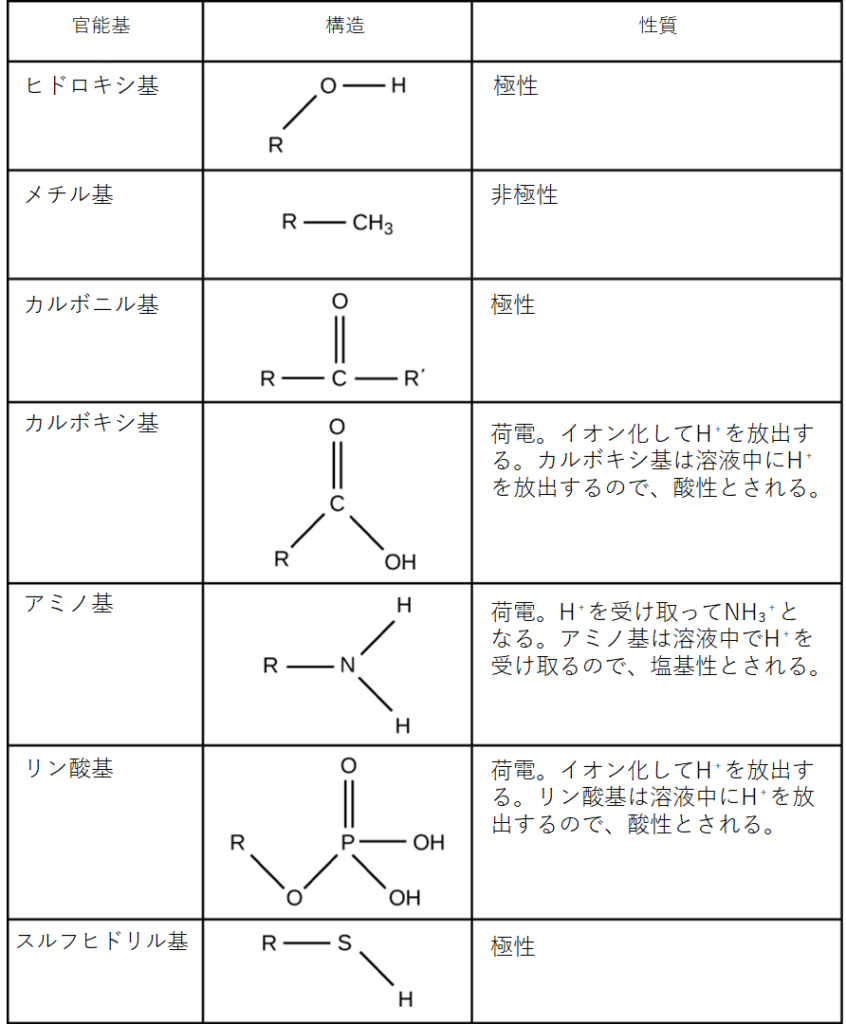
官能基間(同じ分子内、または異なる分子間)の水素結合は、多くの高分子の機能にとって重要であり、それらが機能するのに適した形に折り畳まれたり、それが維持されるのを助けます。また、水素結合は、図2.28が示すように、DNAの相補的塩基対や酵素の基質への結合など、さまざまな認識プロセスにも関与しています。



コメント