学習目標
このセクションを終える頃には、以下のことができるようになっています。
- 生命維持に不可欠な水の特性を説明する。
- 水が優れた溶媒である理由を説明する。
- 水の凝集と付着の例を示す。
- ホメオスタシスにおける酸、塩基、緩衝剤の役割を説明できる。
なぜ科学者は他の惑星で水を探すことに時間をかけるのでしょうか?なぜ水はそれほど重要なのでしょうか?それは、私たちが知っているように、水が生命にとって不可欠だからです。水は、地球上の生命にとって最も重要な分子です。水は人間の体の約60〜70%を占めており、水がなければ、私たちの知っているような生命は存在しません。
水分子の極性とその結果としての水素結合は、水を生命のプロセスと密接に結びついた特別な性質を持つ特有の物質たらしめています。生命はもともと水の中で進化してきたものですし、細胞の化学反応や代謝のほとんどは、細胞質の中にある水の中で行われています。水の特性としては、熱容量や気化熱が大きいこと、極性分子を溶かすことができること、凝集や付着があること、イオンに解離してpHを発生させることなどが挙げられます。このような水の特性を理解することで、生命維持に重要な役割を果たしていることが分かります。
水の極性
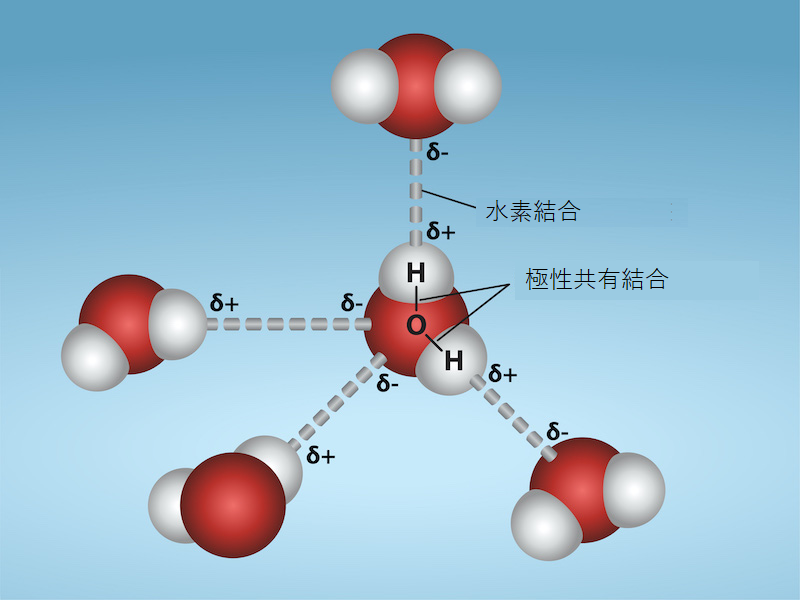
水の重要な特性の1つは、水が極性分子で構成されていることです。水分子(H₂O)を構成する水素と酸素は、極性共有結合を形成しています。水分子には正味の電荷はありませんが、水の極性によって、水素にはわずかに正の電荷、酸素にはわずかに負の電荷が生じ、水の持つ引力の特性につながっています。水が電荷を発生させるのは、酸素が水素よりも電気陰性であるため、共有電子が水素原子核よりも酸素原子核の近くにある可能性が高く、酸素の近くに部分的な負電荷が発生するからです。
水の極性の結果、水分子間の電荷が逆になっていることで、それぞれの水分子が他の水分子を引き寄せ、水素結合を形成します。また、水は他の極性分子やイオンを引き寄せたり、引き寄せられたりもします。水と相互作用しやすい、あるいは水に溶ける極性物質を親水性(hydro-は「水」-philicは「愛する」の意)と呼びます。
一方、油や脂肪などの非極性分子は、図2.13が示すように、水との相互作用がうまくいきません。その良い例が、酢と油のドレッシング(酸性の水溶液)です。このような非極性化合物を疎水性(hydro-=「水」、-phobic=「恐れる」)と呼びます。
水の状態:気体・液体・固体
水素結合の形成は、私たちが知っているような生命に不可欠な液体の水の、重要な性質です。水分子が互いに水素結合を形成することで、水は他の液体に比べてユニークな化学的特性を持つようになります。生物は水を多く含んでいるので、この化学的特性を理解することは、生命を理解する上で重要なことです。液体の水の中では、水の分子が互いにスライドしながら、常に水素結合が形成されたり、切断されたりしています。水分子の運動(運動エネルギー)によって結合は切れますが、これは系に含まれる熱によるものです。水が沸騰して温度が上がると、水分子の運動エネルギーが大きくなって水素結合が完全に切れ、水分子は気体(水蒸気)として空気中に逃げていきます。一方、水温が下がって水が凍ると、水分子は水素結合で維持された結晶構造を形成し(水素結合を切断するほどのエネルギーがない)、氷は液体の水よりも密度が低くなります。これは他の液体が凝固するときには見られない現象です。
水が固体の状態で密度が低いのは、凍るときに水素結合が向きを変えるためです。固体の水分子は、液体の水に比べてより遠くに押し出されているのです。他の多くの液体では、温度が下がって凝固する際に、分子間の運動エネルギーが低下するため、液体のときよりもさらに緊密に分子が集まり、固体の密度が液体よりも高くなります。
氷は密度が低いので、氷山やコップの中の角氷のように、液体の水の表面に浮かんでくるという不思議な現象が起こります(図2.14)。湖や池では、水面に氷が形成され、池に生息する動物や植物を凍結から守る断熱材となります。この氷の層がなければ、池に住む動植物は氷の固まりの中で凍ってしまい、生きていけません。液体の水に比べて氷が膨張していることは、凍結による生物への悪影響を発生させます。凍ってできた氷の結晶は、細胞が機能するために必要なデリケートな膜を破り、細胞を不可逆的に損傷させるのです。細胞は、グリセロールのような別の液体が一時的に水に置き換わることで初めて凍結に耐えられます。

動画で学習
氷の格子構造を立体的に理解するための3Dアニメーション
水の高い熱容量
水の熱容量の大きさは、水分子の水素結合によってもたらされる特性です。水は液体の中で最も高い比熱容量を持っています。比熱とは、ある物質の温度を1℃変化させるために、その物質1gが吸収または失わなければならない熱量のことです。水の場合、この量は1カロリーです。そのため、水は温めるのにも冷やすのにも時間がかかります。実際、水の比熱容量は砂の約5倍もあります。陸地が海よりも早く冷えるのは、このためです。その熱容量の大きさから、温血動物(恒温動物)は水を利用して体内の熱をより均一に分散させています。車の冷却システムと同じように、暖かい場所の熱を冷たい場所に運び、体温をより均一に保つことができるのです。
水の気化熱
水は、1gの液体を気体にするのに必要なエネルギー量である気化熱も大きく、水がこのように変化するためには、かなりの熱エネルギー(586cal)が必要です。このプロセスは水の表面で起こります。水素結合は、液体の水が気体になる際に必要な、水分子同士の分離を困難にしています。その結果、水はヒートシンク(熱だめ)の役割を果たし、エタノール(穀物アルコール)のように、エタノール分子同士の水素結合が水の水素結合よりも弱い液体よりも、沸騰させるために必要な熱量が多くなります。水が沸点の100℃に達すると、熱によって水分子の水素結合が切れ、水分子同士の運動エネルギーによって液体から気体になって逃げ出します。沸点以下でも、水分子は他の水分子から十分なエネルギーを得て、表面の水分子を逃がして気化させることができ、これを蒸発と呼びます。
水が蒸発するために水素結合を切る必要があるということは、その過程で結合にかなりのエネルギーを使っているということです。水が蒸発する際にはエネルギーが使われるので、蒸発した周囲が冷やされます。人間をはじめとする多くの生物は、90%が水である汗を蒸発させることで体を冷やし、体温の恒常性を保っているのです。
水の溶媒としての性質
水はわずかにプラスとマイナスの電荷を持つ極性分子であるため、イオンや極性分子は容易に溶解します。そのため、水は他の極性分子やイオン性化合物を溶かすことができる物質、すなわち溶媒と呼ばれます。これらの分子に付随する電荷は水と水素結合を形成し、水分子で粒子を取り囲みます。これを図2.15のように水和殻または水和球と呼び、粒子を水中で分離または分散させる役割を果たします。
水にイオン性化合物を加えると、個々のイオンが水分子の極性領域と反応し、イオン結合が破壊されて解離が起こります。解離とは、原子や原子団が分子から離れてイオンになることです。例えば、水にNaClの結晶を加えると、NaCl分子が解離してNa⁺イオンとCl⁻イオンになり、図2.15のようにイオンの周りに水和ができます。ここでは、水分子の水素の部分的な正電荷が、負の電荷を持つ塩化物イオンを取り囲み、水分子の酸素が持つ部分的な負電荷は、正の電荷を持つナトリウムイオンを取り囲んでいます。
水の凝集と付着
コップ一杯まで水を入れてから、少しずつ水を足していったことはありませんか?水があふれ出す前に、水はグラスの縁の上にドーム状に盛り上がります。このように水がグラスの上に留まることができるのは、凝集という性質があるからです。凝集とは、(水素結合により)水分子同士が引き合うことで、グラスの中にスペースがないにもかかわらず、液体と気体(水と空気)の境界面で分子が一緒になっていることです。
凝集があるからこそ、表面張力(張力や応力がかかったときに物質が破裂しない能力)が働きます。水が乾いた表面に置かれたとき、重力によって平らにならずに水滴を形成するのもこのためです。水滴の上に小さな紙を置くと、紙の方が水よりも密度が高く(重く)ても、紙は上に浮きます。凝集と表面張力によって、水分子の水素結合が維持され、上に浮いているものを支えているのです。図2.16に示すように、表面張力を壊さないように静かに置けば、水の入ったグラスの上に針を「浮かせる」ことも可能です。

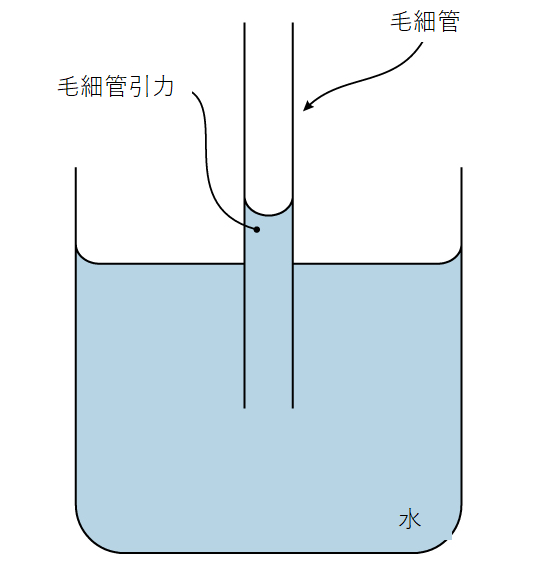
こうした凝集力は、水の特性である付着、すなわち水分子と他の分子との間の引力に関連しています。この引力は、水の凝集力よりも強い場合があります。毛細管と呼ばれる細いガラス管の内側のように、水が帯電した表面にさらされている場合は特にそうです。水の入ったグラスの中に置かれた管を水が「登る」とき、付着を観察することができます。管の中央よりも側面の方が水が高く見えるのです。これは、水分子が、毛細管の帯電したガラス壁に、お互いよりも多く引き寄せられ、付着したためです。図2.17が示すように、このような付着を毛細管現象と呼びます。
凝集力と付着力はなぜ生命にとって重要なのでしょうか?凝集力と付着力は、植物の根から葉へと水を運ぶのに重要なのです。この力は、水柱に「引っ張る力」をもたらします。これは、植物の表面で蒸発した水分子が、その下にある水分子とつながっているために、それらも引っ張られるという性質に由来します。植物はこの自然現象を利用して、根から葉への水の運搬を行っているのです。このような水の性質がなければ、植物は必要な水やそれに溶けたミネラルを受け取ることができません。また、アメンボなどの昆虫は、図2.18に示すように、水の表面張力を利用することで表層で浮いたり、交尾をしたりしています。

pH、緩衝液、酸、塩基
溶液のpHは、その溶液の酸性度または塩基性度を示します。
$$ \mathrm{H₂O(I)↔H⁺(aq)+OH⁻(aq)}$$
リトマス紙やpH紙は、天然の水溶性染料で処理されたpH指示薬用の濾紙で、皆さんも使ったことがあるかもしれません。これらは、溶液中の酸(酸性)や塩基(塩基性)の量を調べるものです。プールの水が適切に処理されているかどうかを調べるために使ったことがある人もいるかもしれません。いずれの場合も、pH試験では、溶液中の水素イオンの濃度を測定します。
純水中の水素イオンは、ごく一部の水分子が解離(イオン化)して、同数の水素(H⁺)イオンと水酸化物(OH⁻)イオンになることで、自然に発生します。水酸化物イオンの方は、他の水分子との水素結合によって溶液中に保たれていますが、むきだしの陽子からなる水素イオンは、イオン化していない水分子に直ちに引き寄せられ、ヒドロニウムイオン(H₃O⁺)を形成します。しかし、科学者たちは慣習的に、水素イオンとその濃度をあたかも液体の水の中でこの状態で自由になっているかのように扱います。
純水から解離した水素イオンの濃度は、水1リットルあたり1×10-7モルです。モル(mol)とは、物質(原子、分子、イオンなど)の量を表す方法です。1モルは、物質の原子量をグラムで表したもので、12グラムの12Cに含まれる原子と同数を1とした物質の量に相当します。数学的には、1モルはその物質の6.02×1023個の粒子に相当します。したがって、1モルの水は、6.02×1023個の水分子に相当します。pHは、この濃度の負の対数(底は10)を計算して求めます。1×10-7のlog10は-7.0なので,この数値の正負を逆にしたものがpH(=7.0)で,この場合のpHは中性です。人間の細胞内や血液内などでは、中性に近いpHが保たれています。
中性にならないのは,酸や塩基を水に溶かした場合です。負の対数を使って正の整数に直すと,水素イオンの濃度が高いときpHは低くなり,逆に水素イオンの濃度が低いときpHは高くなります。酸は、通常、その水素原子の1つが解離することによって、溶液中の水素イオン(H⁺)の濃度を増加させる物質である。塩基は、水酸化物イオン(OH⁻)またはその他の負電荷のイオンを供給し、それが水素イオンと結合することで、溶液中の水素イオンの濃度を低下させ、それによってpHを上昇させます。塩基が水酸化物イオンを放出する場合には、水酸化物イオンが遊離(他と化合せずに存在していること)した水素イオンと結合し、新たな水分子を生成します。
酸が強ければ強いほど、H⁺の供与が容易になります。例えば、塩酸は水素イオンと塩化物イオンに完全に解離して強酸性となりますが、トマトジュースや酢に含まれる酸は完全に解離せず弱酸性となります。逆に、強塩基は、容易にOH⁻を供与したり、水素イオンを取り込んだりする物質のことです。水酸化ナトリウム(NaOH)や家庭用洗剤の多くは強塩基性(強アルカリ性)で、水に入れるとすぐにOH⁻を与えてpHを上げます。弱塩基性溶液の例としては海水があり、そのpHは8およそ8.0です。これは中性に近いため、海洋生物は塩分の多い環境で生きていくために適応してきました。
pHスケールは、先に述べたように、負の常用対数で、0から14までの範囲を示します(図2.19)。7.0以下(0.0〜6.9)は酸性、7.0以上(7.1〜14.0)は塩基性(アルカリ性)です。通常、7.0からどちらかの方向に極端なpHは、生命にとって不都合なものです。細胞内のpHは6.8、血液中のpHは7.4と、いずれも中性に近いものになっています。しかし、胃の中はpH1〜2という強酸性の環境です。そのような酸性の環境で、胃の細胞はどのようにして生きているのでしょうか?また、どのようにして体内の中性に近いpHを恒常的に維持しているのでしょうか?
実は、胃の細胞は、それができずに常に死滅しています。胃は常に新しい細胞を作り出し、死んだ細胞を胃酸で消化しているのです。科学者によると、人間の体は7〜10日ごとに胃の粘膜を完全に入れ替えているといいます。

(credit: modification of work by Edward Stevens)
動画で学習
pHスケールについてわかりやすく説明した動画
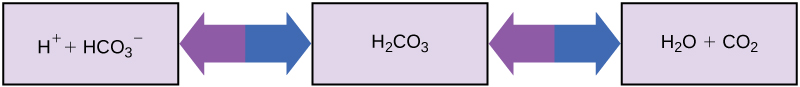
中性に近いpHを必要とする生物が、酸性や塩基性の物質を摂取しても(例えば人間がオレンジジュースを飲んでも)、なぜ生きていけるのでしょうか?その鍵となるのが緩衝液です。緩衝液(バッファー)は、過剰なH+やOH-を吸収し、体内のpHを生存に必要な狭い範囲に維持します。血液のpHを一定に保つことは、人が健康であるために非常に重要です。人間の血液のpHを維持する緩衝液には、炭酸(H₂CO₃)、重炭酸イオン(HCO₃⁻)、二酸化炭素(CO₂)があります。重炭酸イオンが遊離の水素イオンと結合して炭酸になると、水素イオンが除去され、pHの変化が緩やかになります。同様に、図2.20が示すように、過剰な炭酸は二酸化炭素ガスに変化し、私たちは肺から息を吐き出します。これにより、血液中に遊離の水素イオンが増えすぎて、血液のpHが危険なほど低下するのを防ぐことができます。同様に、水酸化ナトリウムが体内に増えすぎると、炭酸が水酸化ナトリウムと結合して重炭酸塩(HCO₃⁻)を生成し、pHを低下させます。この緩衝システムがなければ、体内のpHは生存を脅かすほど変動してしまいます。
緩衝液の他の例としては、過剰な胃酸に対処するために使用する制酸薬があります。これらの市販薬の多くは、血液の緩衝剤と同じ働きをします。通常、水素を吸収してpHを調整できるイオンが1つ以上含まれているので、食後の胸焼けに悩まされている人も安心です。このようなpHバランスをとる能力に貢献する水のユニークな特性は、水の他の特性と同様に、地球上の生命を維持するために不可欠なものなのです。
記事で学習
水について詳しく知りたい方は、米国地質調査所のWater Science for Schools をご覧ください。
脚注
1W. Humphrey W., A. Dalke, and K. Schulten, “VMD-Visual Molecular Dynamics,” Journal of Molecular Graphics 14 (1996): 33-38.





コメント