2.2 水
このセクションを読み終える頃には、あなたは次のことができるようになるでしょう。
- 生命維持に不可欠な水の特性を説明できる。
- 水が優れた溶媒である理由を説明できる。
- 水の凝集性と付着性の例を挙げることができる。
- 恒常性における酸、塩基、緩衝液の役割について議論できる。
科学者たちはなぜ他の惑星で水を探すことに時間を費やすのでしょうか?なぜ水はそれほど重要なのでしょうか?それは、水が私たちが知っている生命にとって不可欠だからです。水は、より豊富な分子の一つであり、地球上の生命にとって最も重要なものです。水は人体の約60〜70パーセントを占めています。それがなければ、私たちが知っている生命は単に存在しないでしょう。
水分子の極性と、その結果生じる水素結合は、水を特別な特性を持つユニークな物質にし、それらは生命のプロセスと密接に結びついています。生命はもともと水のような環境で進化し、生物の細胞化学と代謝のほとんどは、細胞の細胞質の水っぽい内容物の中で起こります。水の特別な特性は、その高い熱容量と蒸発熱、極性分子を溶解する能力、その凝集性と付着性、そしてpH生成につながるイオンへの解離です。これらの水の特性を理解することは、生命維持におけるその重要性を解明するのに役立ちます。
水の極性
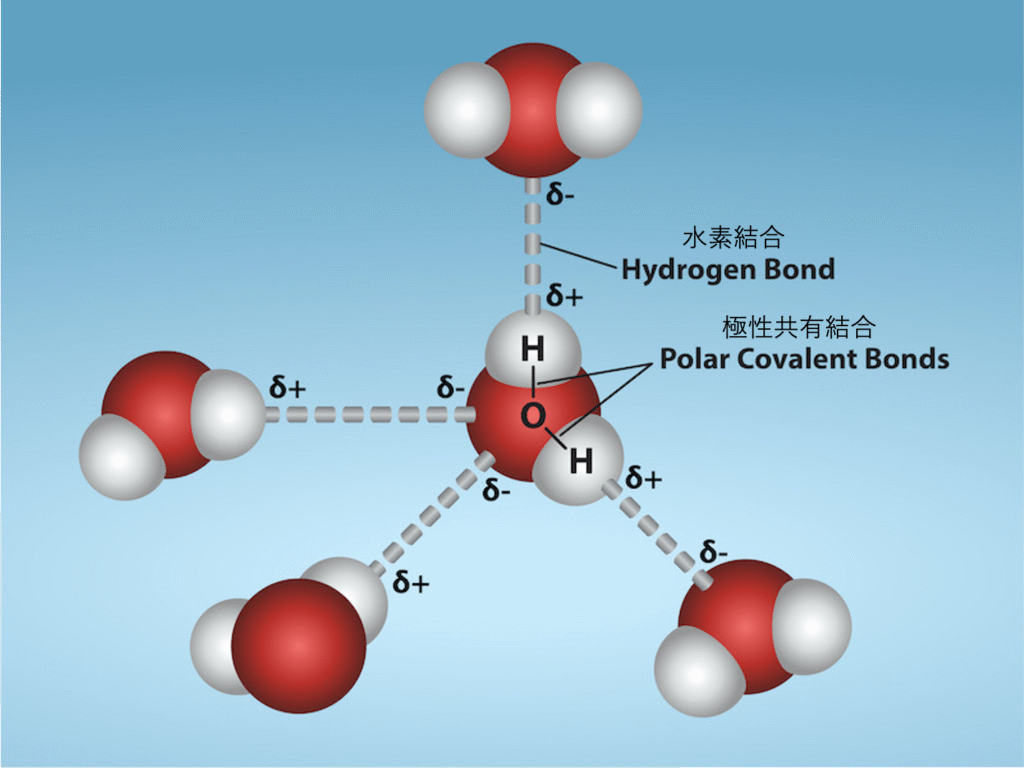
水の重要な特性の一つは、それが極性分子で構成されていることです。水分子(H$_2$O)内の水素原子と酸素原子は、極性共有結合 (polar covalent bond) を形成します。水分子には正味の電荷はありませんが、水の極性は水素にわずかに正の電荷を、酸素にわずかに負の電荷を生み出し、水の引力の特性に寄与します。酸素は水素よりも電気陰性度 (electronegativity) が高いため、水は電荷を生成します。これにより、共有電子が水素原子核よりも酸素原子核の近くにある可能性が高くなり、酸素の近くに部分的な負電荷が生成されます。
水の極性の結果として、各水分子は、水分子間の反対の電荷のために他の水分子を引き付け、水素結合 (hydrogen bond) を形成します。水はまた、他の極性分子やイオンを引き付けたり、引き付けられたりします。水と容易に相互作用するか、水に溶ける極性物質を親水性 (hydrophilic)(hydro- = 「水」; -philic = 「愛する」)と呼びます。対照的に、油や脂肪のような無極性分子は、図2.13が示すように、水とよく相互作用しません。この良い例は、酢と油のサラダドレッシング(酸性の水溶液)です。そのような無極性化合物を疎水性 (hydrophobic)(hydro- = 「水」; -phobic = 「恐れる」)と呼びます。
水の状態:気体、液体、固体
水素結合の形成は、私たちが知っている生命にとって不可欠な液体水の重要な性質です。水分子が互いに水素結合を形成すると、水は他の液体と比較していくつかのユニークな化学的特性を帯びます。そして、生物は高い水分含有量を持っているため、これらの化学的特徴を理解することは生命を理解する鍵となります。液体水中では、水分子が互いに滑り落ちるときに水素結合が絶えず形成され、壊れます。水分子の運動(運動エネルギー)は、システムに含まれる熱のために結合を壊します。水が沸騰するときに熱が上昇すると、水分子の高い運動エネルギーが水素結合を完全に壊し、水分子がガス(蒸気または水蒸気)として空気中に逃げることを可能にします。あるいは、水温が低下し、水が凍結すると、水分子は水素結合によって維持される結晶構造を形成します(水素結合を壊すのに十分なエネルギーがありません)。これにより、氷は液体水よりも密度が低くなります。これは、他の液体が固化するときには見られない現象です。
固体状態での水の密度が低いのは、凍結するときに水素結合が配向する方法によるものです。水分子は液体水と比較してさらに離れて押し出されます。他のほとんどの液体では、温度が低下するときの固化には、分子間の運動エネルギーの低下が含まれ、それらが液体状態よりもさらに密に詰まることを可能にし、固体に液体よりも大きな密度を与えます。
図2.14が示すように、氷の密度が低いという異常な性質により、氷山やグラスの水中の氷のように、液体水の表面に浮かぶことができます。湖や池では、氷が水の表面に形成され、池の中の動物や植物が凍結するのを防ぐ断熱バリアを作成します。この断熱氷層がなければ、池に生息する植物や動物は固体の氷の塊の中で凍結し、生き残ることはできませんでした。液体水に対する氷の膨張は、生物に対する凍結の有害な影響を引き起こします。凍結時に形成される氷の結晶は、生細胞が機能するために不可欠な繊細な膜を破裂させ、不可逆的に損傷します。細胞は、グリセロールのような別の液体が一時的にそれらの中の水を置き換えた場合にのみ凍結を生き残ることができます。

学びへのリンク
氷の格子構造の3Dアニメーションをご覧ください。
水の高い比熱容量
水の高い比熱容量は、水分子間の水素結合によって引き起こされる特性です。水は、あらゆる液体の中で最も高い比熱容量 (specific heat capacity) を持っています。比熱とは、1グラムの物質の温度を摂氏1度変化させるために吸収または放出しなければならない熱量と定義されます。水の場合、この量は1カロリー (calorie) です。したがって、水は温まるのに時間がかかり、冷めるのにも時間がかかります。実際、水の比熱容量は砂の約5倍です。これが、陸地が海よりも速く冷える理由を説明しています。その高い比熱容量のため、温血動物は体内で熱をより均一に分散させるために水を使用します。それは車の冷却システムと同様の方法で機能し、暖かい場所から冷たい場所へ熱を輸送し、体がより均一な温度を維持するようにします。
水の蒸発熱
水はまた、高い蒸発熱 (heat of vaporization) を持っています。これは、1グラムの液体物質を気体に変えるのに必要なエネルギー量です。この変化を水中で達成するには、かなりの量の熱エネルギー(586 cal)が必要です。このプロセスは水の表面で起こります。液体水が加熱されると、水素結合により液体水分子が互いに分離することが困難になり、これが気相(蒸気)に入るために必要です。その結果、水はヒートシンクまたは熱貯蔵庫として機能し、エタノール(穀物アルコール)のような液体よりも沸騰させるためにはるかに多くの熱を必要とします。エタノール分子との水素結合は、水の水素結合よりも弱いです。最終的に、水が沸点である摂氏100度(華氏212度)に達すると、熱は水分子間の水素結合を壊すことができ、水分子間の運動エネルギー(運動)により、それらは液体から気体として逃げることができます。沸点以下であっても、水の個々の分子は他の水分子から十分なエネルギーを獲得するため、一部の表面水分子が逃げて蒸発することができます。このプロセスを蒸発 (evaporation) と呼びます。
水が蒸発するためには水素結合を壊す必要があるという事実は、そのプロセスでかなりの量のエネルギーが使用されることを意味します。水が蒸発すると、プロセスによってエネルギーが吸収され、蒸発が起こっている環境が冷却されます。人間を含む多くの生物では、90パーセントが水である汗の蒸発により、生物は体温の恒常性を維持できるように冷却することができます。
水の溶媒特性
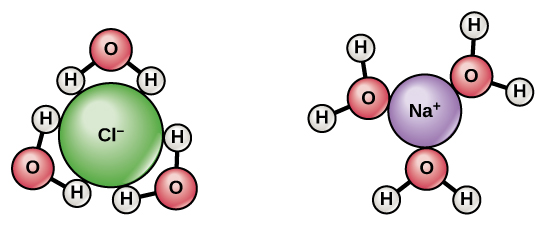
水はわずかに正と負の電荷を持つ極性分子であるため、イオンや極性分子は容易にその中に溶けることができます。したがって、水を溶媒 (solvent)、つまり他の極性分子やイオン化合物を溶解できる物質と呼びます。これらの分子に関連する電荷は水と水素結合を形成し、粒子を水分子で囲みます。これを水和球 (sphere of hydration)、または水和殻と呼びます(図2.15参照)。これは、粒子を水中で分離または分散させておくのに役立ちます。
イオン化合物を水に加えると、個々のイオンは水分子の極性領域と反応し、それらのイオン結合は解離 (dissociation) の過程で破壊されます。解離は、原子または原子団が分子から分離してイオンを形成するときに起こります。食卓塩(NaCl、または塩化ナトリウム)を考えてみましょう。NaCl結晶を水に加えると、NaCl分子はNa$^+$イオンとCl$^-$イオンに解離し、イオンの周りに水和球が形成されます(図2.15参照)。水分子の酸素の部分的な負電荷が、正に帯電したナトリウムイオンを取り囲みます。水分子の水素の部分的な正電荷が、負に帯電した塩化物イオンを取り囲みます。
水の凝集性と付着性
グラスに水を一杯まで満たし、その後ゆっくりと数滴加えたことはありますか?あふれる前に、水はグラスの縁の上にドーム状の形を形成します。この水は、凝集性 (cohesion) の特性のためにグラスの上にとどまることができます。凝集性では、水分子は互いに引き付けられ(水素結合のため)、液体と気体(水と空気)の界面で分子を一緒に保ちますが、グラスにはもうスペースはありません。
凝集性は表面張力 (surface tension)、つまり張力または応力下に置かれたときに破裂に耐える物質の能力を可能にします。これが、水が乾燥した表面上で重力によって平らになるのではなく、液滴を形成する理由でもあります。小さな紙片を水滴の上に置くと、紙は水よりも密度が高い(重い)にもかかわらず、上に浮きます。凝集性と表面張力は、水分子の水素結合を無傷に保ち、上に浮かんでいるアイテムを支えます。表面張力を壊さずに優しく置けば、グラスの水の表面に針を「浮かせる」ことさえ可能です(図2.16参照)。

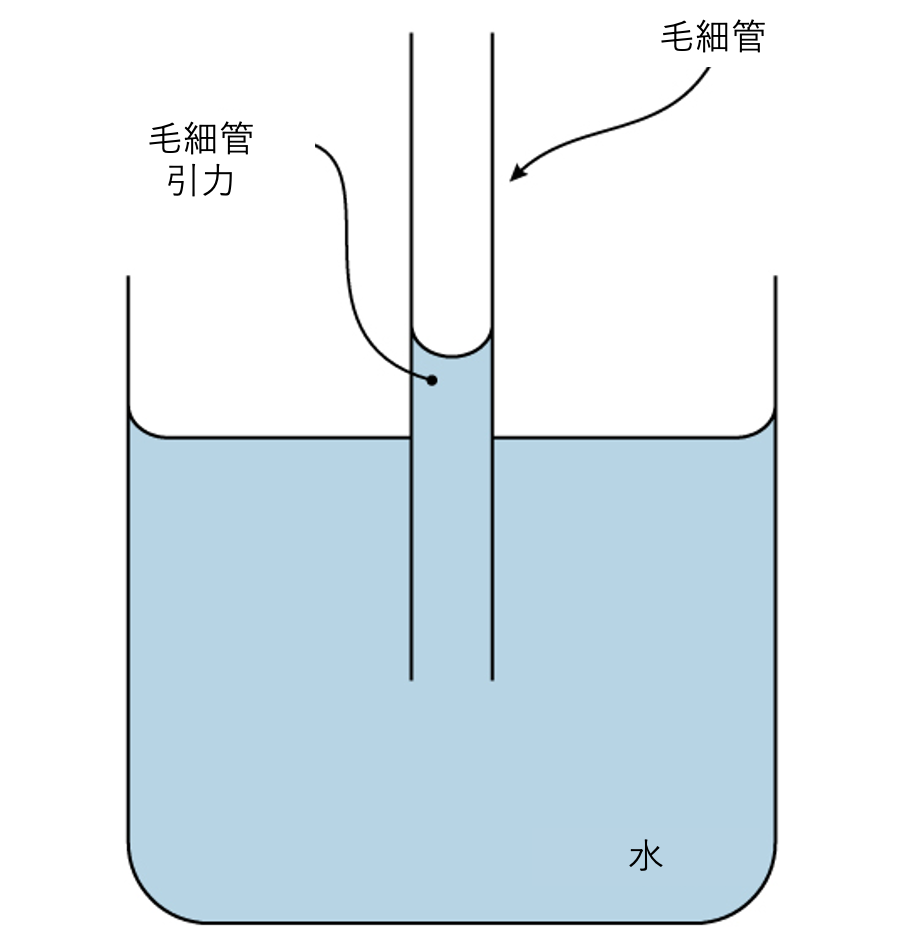
これらの凝集力は、水の付着性 (adhesion)、つまり水分子と他の分子との間の引力に関連しています。この引力は、特に水が毛細管として知られる細いガラス管の内側のような帯電した表面にさらされる場合、水の凝集力よりも強いことがあります。水がグラスの水に入れられた管を「登る」ときに付着性が観察されます。水は中央よりも管の側面で高く見えることに注意してください。これは、水分子が互いに引き付けられるよりも、毛細管の帯電したガラス壁に引き付けられ、したがってそれに付着するためです。この種の付着を毛細管現象 (capillary action) と呼びます(図2.17参照)。
なぜ凝集力と付着力が生命にとって重要なのでしょうか?凝集力と付着力は、植物の根から葉への水の輸送に重要です。これらの力は水柱に「引っ張り」を生み出します。この引っ張りは、植物の表面で蒸発する水分子がその下の水分子に接続したままでいる傾向から生じ、したがってそれらは一緒に引っ張られます。植物はこの自然現象を利用して、根から葉へ水を輸送するのを助けます。これらの水の特性がなければ、植物は必要な水と溶存ミネラルを受け取ることができません。別の例では、図2.18に示すように、アメンボのような昆虫は、水の表面張力を利用して水の表面層に浮かび続け、そこで交尾さえします。

pH、緩衝液、酸、塩基
溶液のpH (pH) は、その酸性度または塩基性度を示します。
おそらくリトマス紙やpH試験紙を使ったことがあるでしょう。これは、pH指示薬として使用するために天然の水溶性染料で処理されたろ紙であり、溶液中にどれだけの酸 (acid)(酸性度)または塩基 (base)(塩基性度)が存在するかをテストします。スイミングプールの水が適切に処理されているかどうかをテストするためにいくつか使用したことさえあるかもしれません。どちらの場合も、pHテストは特定の溶液中の水素イオン濃度を測定します。
水素イオンは、少量の水分子が等しい数の水素(H$^+$)イオンと水酸化物(OH$^-$)イオンに解離(イオン化)することによって純水中で自発的に生成されます。水酸化物イオンは他の水分子との水素結合によって溶液中に保持されますが、裸のプロトンからなる水素イオンは、すぐに非イオン化水分子に引き付けられ、ヒドロニウムイオン(H$_3$O$^+$)を形成します。それでも、慣例により、科学者は水素イオンとその濃度を、液体水中でこの状態で自由であるかのように参照します。
純水から解離する水素イオンの濃度は、1リットルの水あたり $1 \times 10^{-7}$ モルのH$^+$イオンです。モル (mol) は、物質(原子、分子、イオンなど)の量を表す方法です。1モルは、物質の原子量をグラムで表したものであり、$^{12}$Cの12グラムに含まれる原子数と同じ数の単位を含む物質の量に等しくなります。数学的には、1モルは物質の$6.02 \times 10^{23}$個の粒子に等しいです。したがって、1モルの水は$6.02 \times 10^{23}$個の水分子に等しいです。pHは、この濃度の常用対数(底10の対数)の負の値として計算されます。$1 \times 10^{-7}$ のlog$_{10}$は-7.0であり、この数値の負(「pH」の「p」で示される)は7.0のpHをもたらし、これは中性のpHでもあります。ヒト細胞内および血液中のpHは、中性付近のpHが維持されている体内の2つの領域の例です。
非中性のpH測定値は、酸または塩基を水に溶解することによって生じます。正の整数を生成するために負の対数を使用すると、水素イオン濃度が高いと低いpH値が得られます。一方、水素イオン濃度が低いと高いpHが得られます。酸は、通常、その水素原子の1つが解離することによって、溶液中の水素イオン(H$^+$)濃度を増加させる物質です。塩基は、水酸化物イオン(OH$^-$)または水素イオンと結合する他の負に帯電したイオンのいずれかを提供し、溶液中のそれらの濃度を低下させ、それによってpHを上昇させます。塩基が水酸化物イオンを放出する場合、これらのイオンは遊離水素イオンに結合し、新しい水分子を生成します。
酸が強いほど、H$^+$をより容易に供与します。たとえば、塩酸(HCl)は完全に水素イオンと塩化物イオンに解離し、非常に酸性です。一方、トマトジュースや酢に含まれる酸は完全には解離せず、弱酸です。逆に、強塩基は、OH$^-$を容易に供与するか、水素イオンを取り込む物質です。水酸化ナトリウム(NaOH)や多くの家庭用洗剤は非常にアルカリ性であり、水に入れると急速にOH$^-$を放出し、それによってpHを上昇させます。弱塩基性溶液の一例は海水であり、pHは約8.0です。これは中性のpHに十分に近く、海洋生物はその塩分環境で生息し繁栄するために適応してきました。
pHスケール (pH scale) は、前述のように、逆対数であり、0から14の範囲です(図2.19)。7.0未満(0.0から6.9の範囲)は酸性であり、7.0超(7.1から14.0の範囲)はアルカリ性です。7.0からのどちらの方向への極端なpHも、通常、生命には適していません。細胞内のpH(6.8)と血液中のpH(7.4)はどちらも中性に非常に近いです。しかし、胃の中の環境は非常に酸性であり、pHは1〜2です。その結果、胃細胞はそのような酸性環境でどのように生き残るのでしょうか?それらはどのようにして内部のほぼ中性のpHを恒常的に維持するのでしょうか?答えは、それらはそれを行うことができず、絶えず死んでいるということです。胃は絶えず新しい細胞を生成して死んだ細胞を置き換え、胃酸はそれらを消化します。科学者は、人体が胃の内壁を7〜10日ごとに完全に置き換えると推定しています。

学びへのリンク
pHとその対数スケールの簡単な説明については、このビデオをご覧ください。
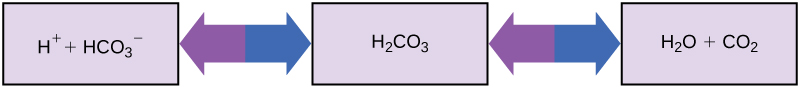
体がほぼ中性のpHを必要とする生物は、どのようにして酸性および塩基性の物質(例えば、オレンジジュースを飲む人間)を摂取して生き残ることができるのでしょうか?緩衝液 (buffer) が鍵です。緩衝液は過剰なH$^+$またはOH$^-$を容易に吸収し、体のpHを生存に必要な狭い範囲内に注意深く維持します。一定の血液pHを維持することは、人の健康にとって重要です。ヒト血液のpHを維持する緩衝液には、炭酸(H$_2$CO$_3$)、重炭酸イオン(HCO$_3^-$)、および二酸化炭素(CO$_2$)が含まれます。重炭酸イオンが遊離水素イオンと結合して炭酸になると、水素イオンが除去され、pH変化が緩和されます。同様に、図2.20が示すように、過剰な炭酸は二酸化炭素ガスに変換され、肺を通じて呼気されます。これにより、血液中にあまりにも多くの遊離水素イオンが蓄積し、血液のpHを危険なほど低下させるのを防ぎます。同様に、あまりにも多くのOH$^-$が系に入ると、炭酸がそれと結合して重炭酸塩を生成し、pHを低下させます。この緩衝系がなければ、体のpHは生存を危険にさらすほど変動するでしょう。
緩衝液の他の例としては、過剰な胃酸と戦うために一部の人々が使用する制酸剤があります。これらの市販薬の多くは、血液緩衝液と同じように機能し、通常、水素を吸収してpHを緩和できる少なくとも1つのイオンを含んでおり、食後に「胸焼け」に苦しむ人々に安堵をもたらします。このpHバランス能力に寄与する水のユニークな特性、および水の他の特性は、地球上の生命を維持するために不可欠です。
学びへのリンク
水についてもっと学ぶには、米国地質調査所のWater Science for Schoolsのウェブサイトをご覧ください。





コメント