2.3 炭素
このセクションを読み終える頃には、あなたは次のことができるようになるでしょう。
- 炭素が生命にとって重要である理由を説明できる。
- 生体分子における官能基の役割を説明できる。
タンパク質、核酸(RNAおよびDNA)、炭水化物、脂質など、高分子 (macromolecule) と呼ばれる多くの複雑な分子が細胞を構成しています。高分子は、生命にとって特に重要な有機分子 (organic molecule)(炭素を含む液体、固体、または気体)の一部です。これらのすべての高分子の基本的な構成要素は炭素です。炭素原子は、最大4つの異なる原子と共有結合を形成できるユニークな特性を持っており、この用途の広い元素を高分子の基本的な構造要素、または「骨格」として機能するのに理想的なものにしています。
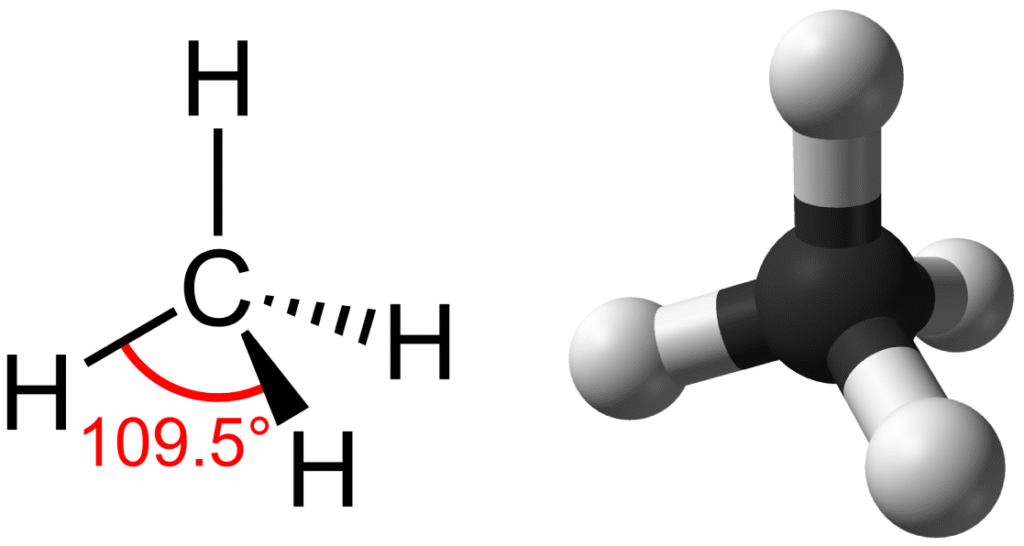
個々の炭素原子は、不完全な最外電子殻を持っています。原子番号6(電子6個と陽子6個)で、最初の2つの電子が内殻を満たし、4つが第2殻に残ります。したがって、炭素原子は、オクテット則を満たすために他の原子と最大4つの共有結合を形成できます。メタン分子はその一例です。化学式はCH$_4$です。その4つの水素原子のそれぞれが、電子対を共有することによって炭素原子と単一の共有結合を形成します。これにより、満たされた最外殻が得られます。
炭化水素
炭化水素 (hydrocarbon) は、上記のメタン(CH$_4$)のように、炭素と水素のみからなる有機分子です。私たちはしばしば、ガスグリルのプロパンやライターのブタンのように、日常生活で炭化水素を燃料として使用します。炭化水素中の原子間の多くの共有結合は、大量のエネルギーを貯蔵しており、これらの分子が燃焼(酸化)するときに放出されます。優れた燃料であるメタンは、最も単純な炭化水素分子であり、中央の炭素原子が4つの異なる水素原子に結合しています(図2.21参照)。その電子軌道の形状が、メタン分子の幾何学的形状、つまり原子が三次元で存在する形状を決定します。炭素原子と4つの水素原子は、四面体(4つの三角形の面を持つ)を形成します。このため、メタンは四面体幾何構造を持つと説明されます。
生物の大きな分子の骨格として、炭化水素は直鎖状の炭素鎖、炭素環、または両方の組み合わせとして存在する可能性があります。さらに、個々の炭素間結合は、単結合、二重結合、または三重共有結合である可能性があり、各結合タイプは分子の幾何学的形状に特定の方法で影響を与えます。生命の大きな分子(高分子)のこの三次元形状またはコンフォメーション(立体配座)は、それらがどのように機能するかにとって重要です。
鎖式炭化水素
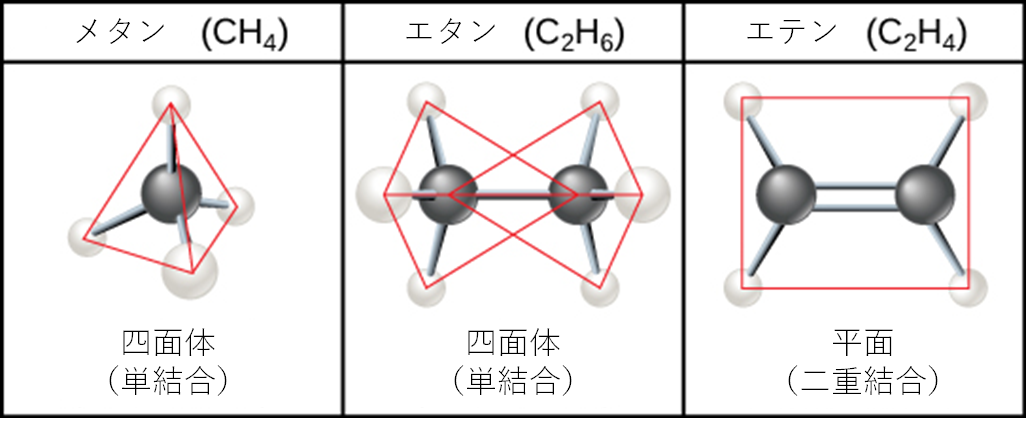
炭素原子間の連続的な結合が炭化水素鎖を形成します。これらは分岐している場合も、分岐していない場合もあります。さらに、分子の単結合、二重結合、三重共有結合の異なる幾何学的形状は、図2.22が示すように、分子全体の幾何学的形状を変えます。炭化水素のエタン、エテン、エチンは、異なる炭素間結合が分子の幾何学的形状にどのように影響するかの例として役立ちます。3つの分子すべての名前は接頭辞「eth-」で始まり、これは2炭素炭化水素の接頭辞です。接尾辞「-ane」、「-ene」、「-yne」は、それぞれ単結合、二重結合、三重炭素-炭素結合の存在を指します。したがって、プロパン、プロペン、プロピンは3炭素分子で同じパターンに従い、ブタン、ブテン、ブチンは4炭素分子などとなります。二重結合と三重結合は分子の幾何学的形状を変えます。単結合は結合軸に沿った回転を可能にしますが、二重結合は平面配置をもたらし、三重結合は直線配置をもたらします。これらの幾何学的形状は、特定の分子が取り得る形状に大きな影響を与えます。
環式炭化水素
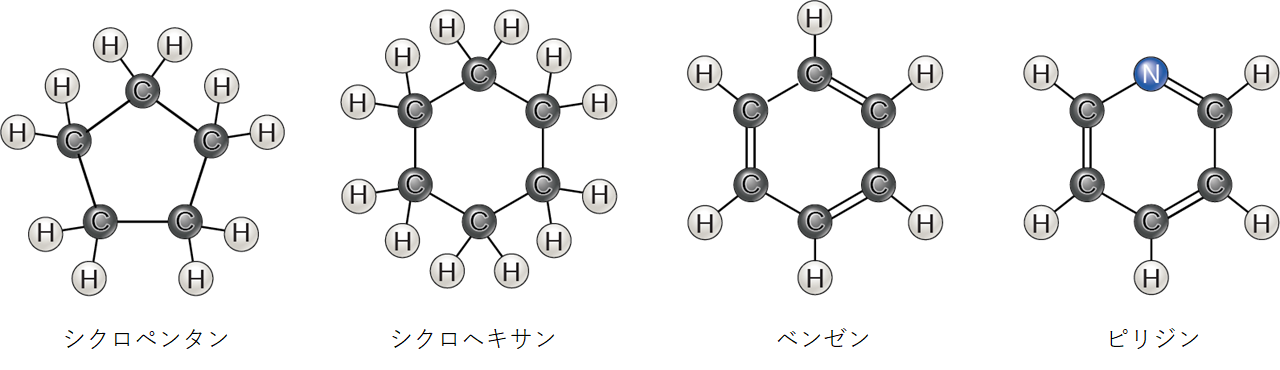
これまで議論してきた炭化水素は、炭素原子の直鎖からなる脂肪族炭化水素 (aliphatic hydrocarbon) でした。別の種類の炭化水素である芳香族炭化水素 (aromatic hydrocarbon) は、単結合と二重結合が交互になった炭素原子の閉環からなります。脂肪族炭化水素にも環構造が見られ、時には二重結合が存在することもあります。これは、図2.23でシクロヘキサンの構造とベンゼンを比較することで確認できます。ベンゼン環を組み込んだ生体分子の例としては、いくつかのアミノ酸、コレステロールとその誘導体(ホルモンのエストロゲンやテストステロンを含む)があります。ベンゼン環は除草剤2,4-Dにも見られます。ベンゼンは原油の天然成分であり、発がん性物質として分類されています。一部の炭化水素は、脂肪族部分と芳香族部分の両方を持っています。β-カロテンはそのような炭化水素の一例です。
異性体
有機分子内の原子と化学結合の三次元配置は、それらの化学を理解する上で中心となります。同じ化学式を共有するが、原子および/または化学結合の配置(構造)が異なる分子を異性体 (isomer) と呼びます。構造異性体 (structural isomer)(図2.24aのブタンとイソブタンのような)は、共有結合の配置が異なります。両方の分子は4つの炭素と10個の水素(C$_4$H$_{10}$)を持っていますが、分子内の原子の配置が異なるため、化学的性質に違いが生じます。たとえば、ブタンはシガレットライターやトーチの燃料としての使用に適していますが、イソブタンは冷媒やスプレー缶の噴射剤としての使用に適しています。
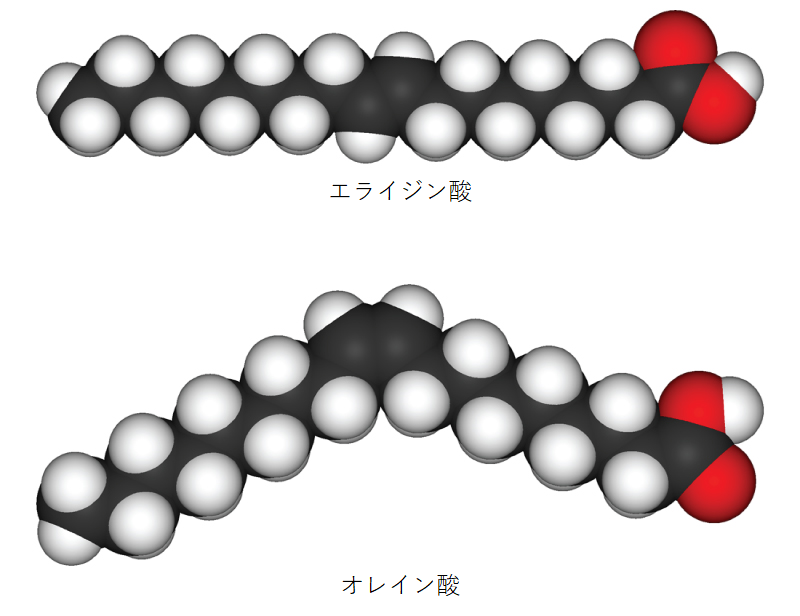
一方、幾何異性体 (geometric isomer) は、共有結合の配置は類似していますが、これらの結合が周囲の原子、特に炭素-炭素二重結合に対してどのように作られているかが異なります。単純な分子ブテン(C$_4$H$_8$)では、2つのメチル基(CH$_3$)が分子の中心にある二重共有結合のどちら側にも存在できます(図2.24b参照)。炭素が二重結合の同じ側に結合している場合、これはシス (cis) 配置です。それらが二重結合の反対側にある場合、それはトランス (trans) 配置です。トランス配置では、炭素は多かれ少なかれ直線的な構造を形成しますが、シス配置の炭素は炭素骨格の曲がり(方向転換)を引き起こします。
トリグリセリド(脂肪および油)では、脂肪酸として知られる長い炭素鎖に二重結合が含まれる場合があり、これらはシスまたはトランスのいずれかの配置である可能性があります(図2.25参照)。炭素原子間に少なくとも1つの二重結合を持つ脂肪は、不飽和脂肪です。これらの結合の一部がシス配置にある場合、鎖の炭素骨格に生じる曲がりは、トリグリセリド分子が密に詰まることができないことを意味し、そのため室温で液体(油)のままです。一方、トランス二重結合を持つトリグリセリド(一般的にトランス脂肪と呼ばれる)は、比較的直鎖状の脂肪酸を持ち、室温で密に詰まることができ、固体の脂肪を形成します。人間の食事では、トランス脂肪は心血管疾患のリスク増加に関連しているため、多くの食品メーカーは近年その使用を削減または排除しています。不飽和脂肪とは対照的に、炭素原子間に二重結合を持たないトリグリセリドを飽和脂肪と呼びます。これは、利用可能なすべての水素原子を含んでいることを意味します。飽和脂肪は室温で固体であり、通常は動物由来です。
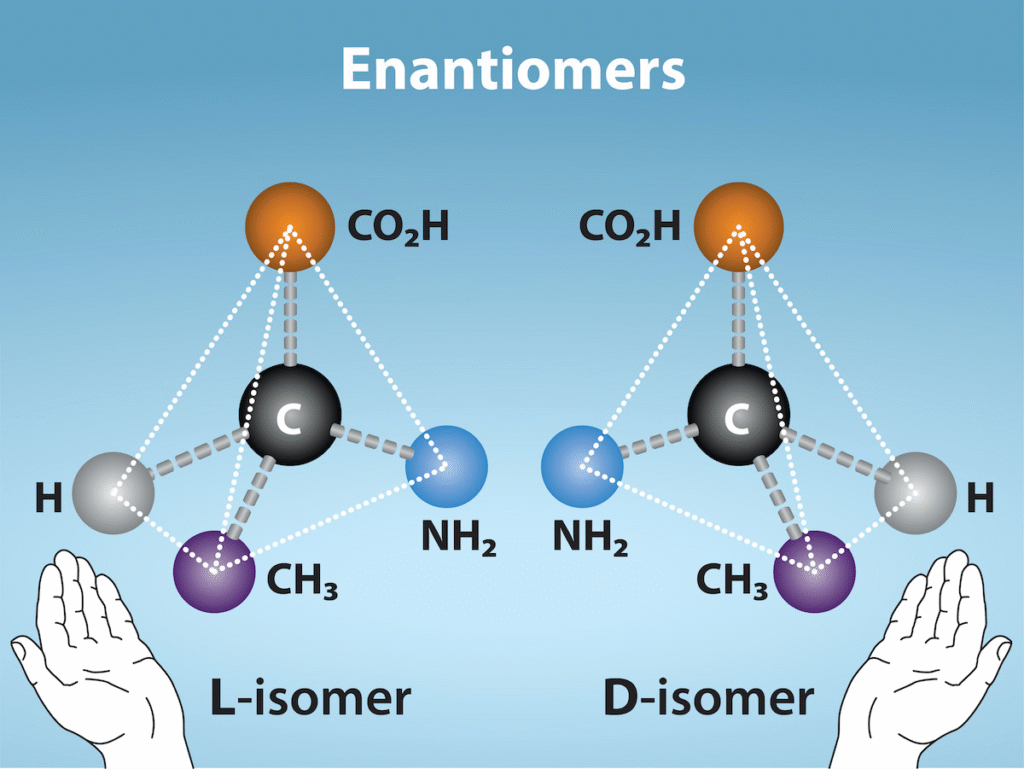
鏡像異性体(エナンチオマー)
鏡像異性体 (エナンチオマー、enantiomer) は、同じ化学構造と化学結合を共有するが、原子の三次元配置が異なるため、重ね合わせることができない鏡像である分子です。図2.26はアミノ酸アラニンの例を示しており、2つの構造は重ね合わせることができません。自然界では、アミノ酸のL型がタンパク質中で優勢です。一部のD型アミノ酸は、細菌の細胞壁や他の生物のポリペプチドに見られます。同様に、グルコースのD型は光合成の主な生成物であり、分子のL型は自然界ではめったに見られません。
図を見て考えよう 2.24
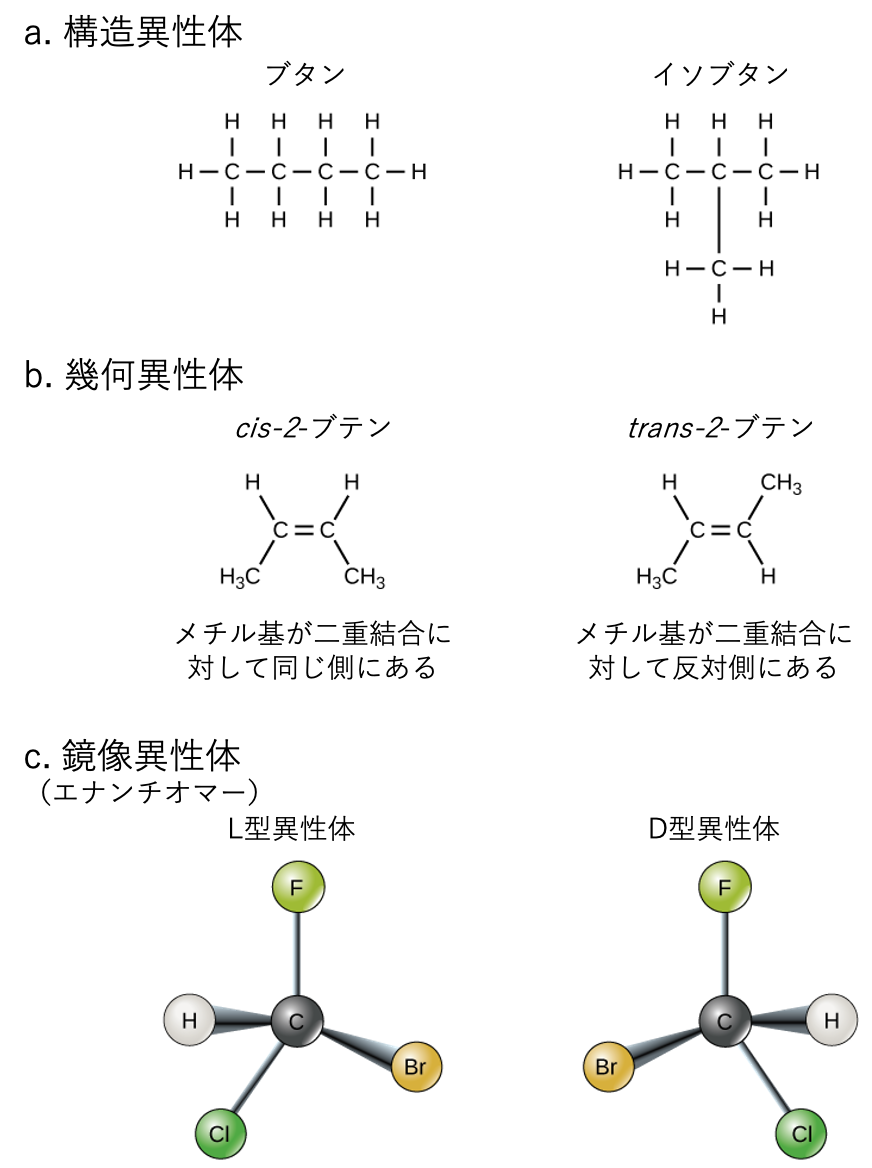
次の記述のうち、誤っているものはどれですか?
a. 化学式 CH$_3$CH$_2$COOH と C$_3$H$_6$O$_2$ を持つ分子は構造異性体である可能性がある。
b. 分子がシス-トランス異性体であるためには、二重結合を持たなければならない。
c. 鏡像異性体であるためには、分子は中心炭素に少なくとも3つの異なる原子または基が結合していなければならない。
d. 鏡像異性体であるためには、分子は中心炭素に少なくとも4つの異なる原子または基が結合していなければならない。
(解答は2.3節末に記載)
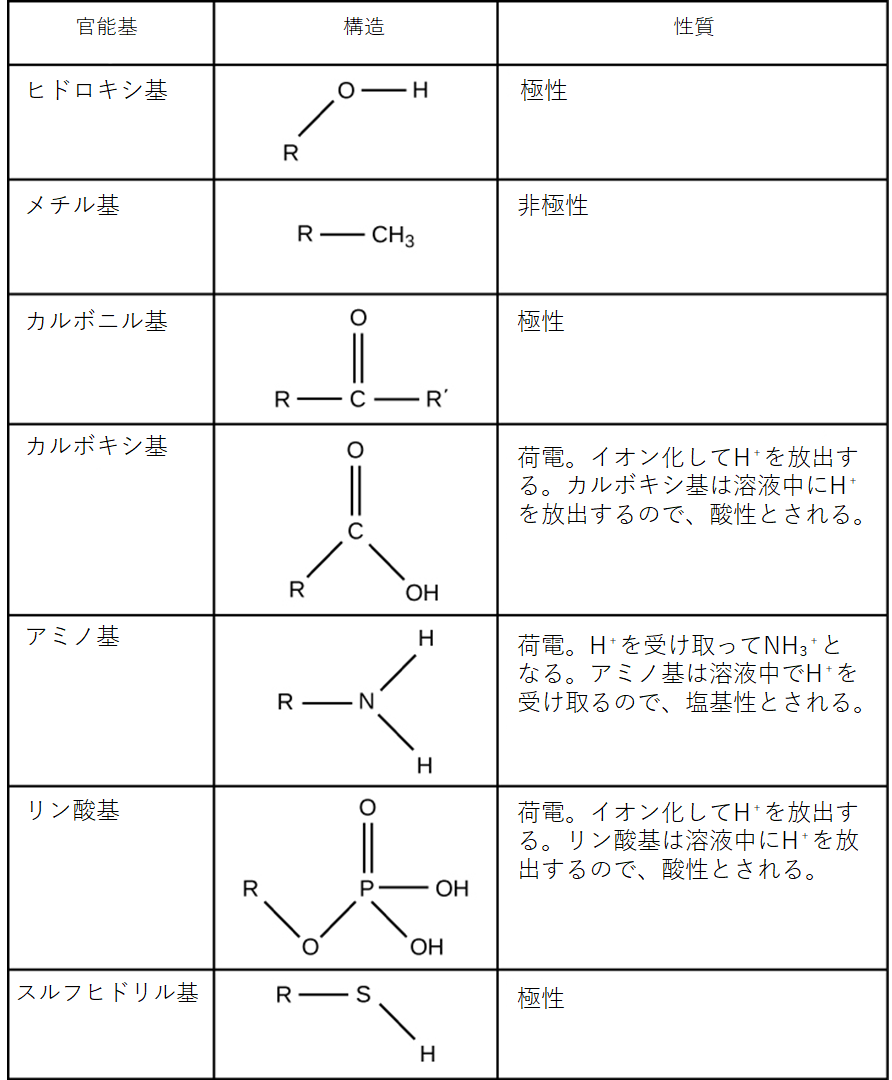
官能基
官能基 (functional group) は、分子内に存在する原子のグループであり、それらの分子に特定の化学的性質を与えます。それらは高分子の「炭素骨格」に沿って見られます。炭素原子の鎖および/または環が、窒素や酸素などの元素が時折置換されることで、この炭素骨格を形成します。炭素骨格に他の元素を持つ分子は、置換炭化水素です。
高分子中の官能基は、通常、その鎖および/または環構造に沿った1つまたは複数の異なる場所で炭素骨格に結合しています。4種類の高分子(タンパク質、脂質、炭水化物、核酸)のそれぞれが、その異なる化学的性質と生物における機能に大きく寄与する独自の特徴的な官能基セットを持っています。
官能基は特定の化学反応に参加できます。図2.27は、生体分子における重要な官能基のいくつかを示しています。それらには、ヒドロキシル基、メチル基、カルボニル基、カルボキシル基、アミノ基、リン酸基、およびスルフヒドリル基が含まれます。これらの基は、DNA、タンパク質、炭水化物、脂質のような分子の形成において重要な役割を果たします。通常、官能基は、その電荷または極性の特性に応じて、疎水性または親水性として分類されます。疎水性基の一例は、無極性のメチル分子です。親水性官能基の中には、アミノ酸、一部のアミノ酸側鎖、およびトリグリセリドとリン脂質を形成する脂肪酸に含まれるカルボキシル基があります。このカルボキシル基はイオン化してCOOH基から水素イオン(H$^+$)を放出し、結果として負に帯電したCOO$^-$基になります。これは、それが存在する分子の親水性に寄与します。カルボニル基のような他の官能基は、水分子と水素結合を形成する可能性のある部分的に負に帯電した酸素原子を持ち、再び分子をより親水性にします。
官能基間の水素結合(同じ分子内または異なる分子間)は、多くの高分子の機能にとって重要であり、それらが機能するための適切な形状に適切に折り畳まれ、維持されるのを助けます。水素結合はまた、DNA相補的塩基対形成や酵素とその基質の結合など、さまざまな認識プロセスにも関与しています(図2.28参照)。
図2.28 水素結合はDNAの2本の鎖を結びつけ、二重らせん構造を作り出します。
2.3 節末の演習解答
図を見て考えよう 2.24 解答
記述 c が誤っています。鏡像異性体であるためには、分子は中心炭素(不斉炭素)に少なくとも4つの異なる原子または基が結合していなければなりません。3つでは鏡像と重ね合わせることができてしまいます。




コメント