2.1 原子、同位体、イオン、分子:構成要素
このセクションを読み終える頃には、あなたは次のことができるようになるでしょう。
- 物質と元素を定義できる。
- 陽子、中性子、電子の相互関係を説明できる。
- 原子間で電子がどのように与えられたり共有されたりするかを比較できる。
- 自然界に存在する元素がどのように組み合わさって、分子、細胞、組織、器官系、そして個々の生物を作り出すのかを説明できる。
最も基本的なレベルで見ると、生命は物質から成り立っています。物質 (matter) とは、空間を占め、質量を持つあらゆるものです。元素 (element) は、特定の化学的および物理的性質を持つ、物質のユニークな形態であり、通常の化学反応ではそれ以上小さな物質に分解することはできません。現在118種類の元素が知られていますが、自然界に存在するのは98種類だけです。残りの元素は不安定で、科学者が実験室で合成する必要があります。
各元素は、その化学記号で表されます。これは、大文字のアルファベット1文字、または最初の文字が既に他の元素に使われている場合は2文字の組み合わせです。炭素のCやカルシウムのCaのように、元素の英語名に従うものもあります。他の元素の化学記号は、そのラテン語名に由来します。例えば、ナトリウムの記号はNaですが、これはラテン語でナトリウムを意味する natrium を参照しています。
すべての生物に共通する4つの主要な元素は、酸素(O)、炭素(C)、水素(H)、そして窒素(N)です。生物以外の世界では、元素は異なる割合で見られます。表2.1が示すように、生物に共通するいくつかの元素は、地球全体としては比較的まれです。例えば、大気は窒素と酸素が豊富ですが、炭素と水素はほとんど含まれていません。一方、地殻は酸素と少量の水素を含んでいますが、窒素と炭素はほとんどありません。存在量に違いはあるものの、すべての元素とそれらの間の化学反応は、生物の一部であろうと非生物の一部であろうと、同じ化学的および物理的法則に従います。
表2.1 生物(ヒト)と非生物界における元素のおおよその割合比較
| 元素 | 生命(ヒト) | 大気 | 地殻 |
|---|---|---|---|
| 酸素 (O) | 65% | 21% | 46% |
| 炭素 (C) | 18% | 微量 | 微量 |
| 水素 (H) | 10% | 微量 | 0.1% |
| 窒素 (N) | 3% | 78% | 微量 |
原子の構造
元素がどのように結びつくかを理解するためには、まず元素の最小の構成要素である原子 (atom) についてお話しなければなりません。原子は、その元素のすべての化学的性質を保持する物質の最小単位です。例えば、一つの金の原子は、室温で固体金属であるという金のすべての性質を持っています。金貨は、単に非常に多数の金原子がコインの形に成形されたものであり、不純物として知られる他の元素を少量含んでいます。金の原子を、金の性質を保ったまま、それ以上小さく分解することはできません。
原子は二つの領域から構成されています。中心にある原子核 (nucleus) には陽子 (proton) と中性子 (neutron) が含まれています。原子の最も外側の領域には、原子核の周りを軌道を描いて回る電子 (electron) が存在します(図2.2参照)。原子は、陽子、電子、中性子、その他の素粒子を含んでいます。唯一の例外は水素(H)で、これは1つの陽子と1つの電子からなり、中性子はありません。
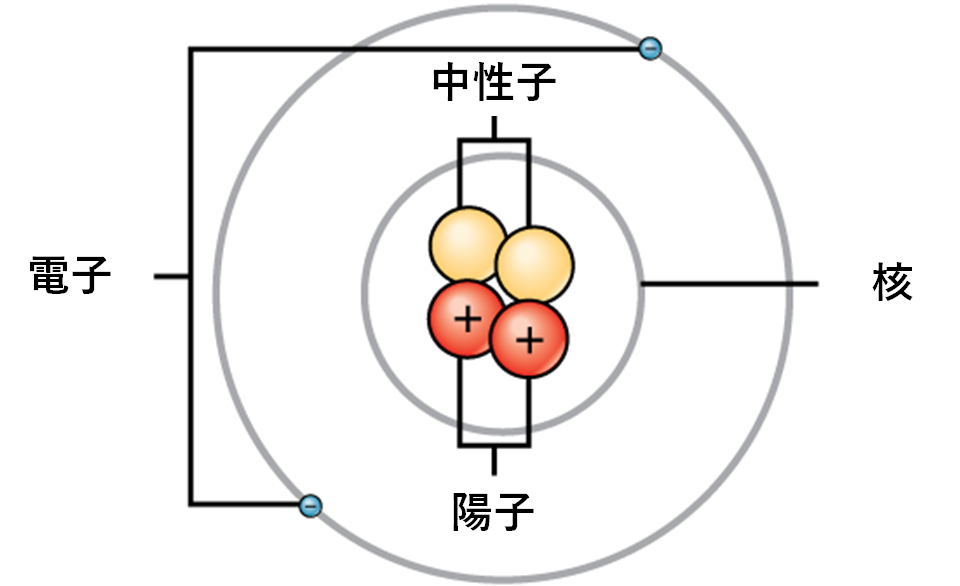
陽子と中性子はほぼ同じ質量を持ち、約 $1.67 \times 10^{-24}$ グラムです。科学者たちは、この質量の量を便宜的に1原子質量単位 (amu; atomic mass unit) または1ダルトン (Dalton) と定義しています(表2.2参照)。質量は似ていますが、陽子と中性子は電荷が異なります。陽子は正の電荷を持っていますが、中性子は電荷を持っていません。したがって、原子内の中性子の数はその質量に大きく寄与しますが、電荷には寄与しません。電子は陽子よりもはるかに質量が小さく、わずか $9.11 \times 10^{-28}$ グラム、つまり原子質量単位の約1/1800しかありません。そのため、元素の全体的な原子質量にはあまり寄与しません。したがって、原子質量を考える際には、電子の質量を無視し、陽子と中性子の数だけに基づいて原子の質量を計算するのが一般的です。質量への寄与は大きくありませんが、電子は原子の電荷に大きく寄与します。なぜなら、各電子は陽子の正電荷と等しい負電荷を持っているからです。電荷を持たない中性の原子では、原子核の周りを回る電子の数は、原子核内部の陽子の数と同じです。これらの原子では、正電荷と負電荷が互いに打ち消し合い、結果として正味の電荷を持たない原子になります。
陽子、中性子、電子の大きさを考慮に入れると、原子の体積のほとんど、99パーセント以上は空の空間です。これほど多くの空の空間があるのに、なぜいわゆる固体物体が互いを通り抜けないのだろうかと疑問に思うかもしれません。その理由は、すべての原子を取り囲む電子が負に帯電しており、負電荷同士は反発しあうからです。
表2.2 陽子、中性子、電子
| 粒子 | 電荷 | 質量 (amu) | 場所 |
|---|---|---|---|
| 陽子 | +1 | 1 | 原子核 |
| 中性子 | 0 | 1 | 原子核 |
| 電子 | –1 | 0 | 軌道 |
原子番号と質量
各元素の原子は、特徴的な数の陽子と電子を含んでいます。陽子の数が元素の原子番号 (atomic number) を決定し、科学者はこれを使って元素を互いに区別します。中性子の数は可変であり、その結果として同位体 (isotope) が生じます。同位体は、同じ原子の異なる形態であり、持つ中性子の数だけが異なります。陽子の数と中性子の数を合わせると、元素の質量数 (mass number) が決まります(図2.3参照)。電子からの質量のわずかな寄与は質量数の計算では無視することに注意してください。この質量の近似値を使うと、質量数から陽子の数を単純に引くことによって、元素が持つ中性子の数を簡単に計算できます。元素の同位体はわずかに異なる質量数を持つため、科学者は原子量 (atomic mass) も決定します。これは、自然に存在する同位体の質量数の計算上の平均値です。しばしば、結果の数値には小数部分が含まれます。例えば、塩素(Cl)の原子量は35.45です。これは、塩素がいくつかの同位体で構成されており、一部(大部分)は原子質量35(陽子17個、中性子18個)を持ち、一部は原子質量37(陽子17個、中性子20個)を持つためです。
図を見て考えよう 2.3
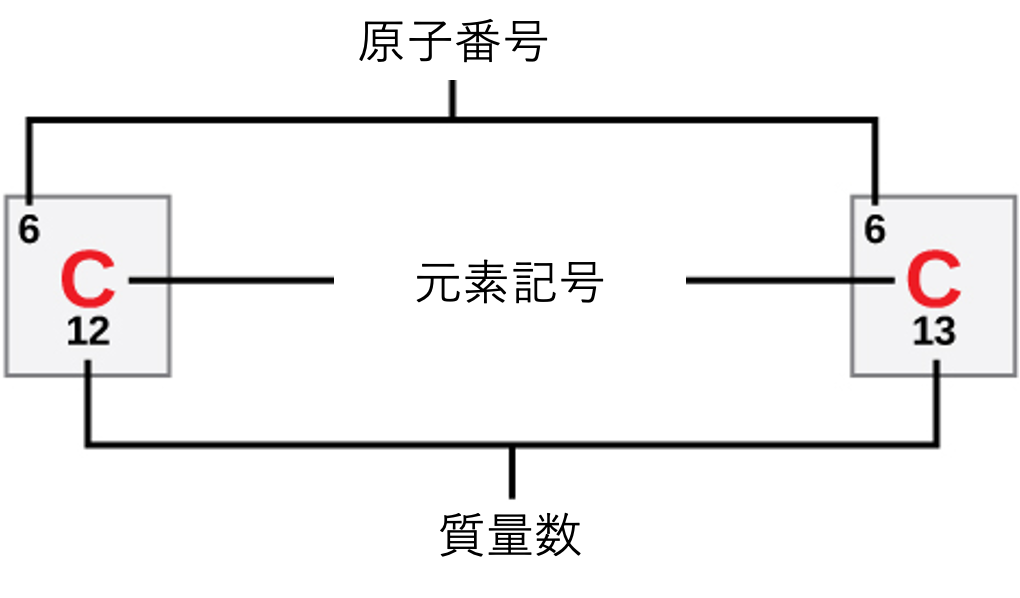
炭素12と炭素13は、それぞれいくつの中性子を持っていますか?
(解答は2.1節末に記載)
同位体
同位体は、同じ数の陽子を持つが中性子の数が異なる元素の異なる形態です。炭素、カリウム、ウランなどのいくつかの元素には、自然に存在する同位体があります。炭素12は、陽子6個、中性子6個、電子6個を含んでいます。したがって、質量数は12(陽子6個と中性子6個)です。炭素14は、陽子6個、中性子8個、電子6個を含んでいます。その原子質量は14(陽子6個と中性子8個)です。これら2つの炭素の代替形態が同位体です。いくつかの同位体は、中性子、陽子、電子を放出し、より安定な原子配置(より低いポテンシャルエネルギー準位)に到達することがあります。これらは放射性同位体 (radioisotope)、またはラジオアイソトープです。放射性崩壊 (radioactive decay)(炭素14が崩壊して最終的に窒素14になること)は、不安定な原子の原子核が放射線を放出するときに起こるエネルギー損失を表します。
進化のつながり
炭素年代測定
炭素は通常、二酸化炭素やメタンのようなガス状化合物の形で大気中に存在します。炭素14($^{14}$C)は自然に存在する放射性同位体であり、宇宙線によって大気中の窒素($^{14}$N)に中性子が加わり、陽子が失われることで生成されます。これは連続的なプロセスであるため、常により多くの$^{14}$Cが生成されています。生物は、最初に光合成のプロセスで固定された二酸化炭素として$^{14}$Cを取り込むため、その体内の$^{14}$Cの相対量は大気中の$^{14}$Cの濃度に等しくなります。生物が死ぬと、もはや$^{14}$Cを摂取しなくなるため、$^{14}$Cと$^{12}$Cの比率は、$^{14}$Cがベータ崩壊 (beta decay)(電子または陽電子の放出)と呼ばれるプロセスによって徐々に$^{14}$Nへと崩壊するにつれて低下します。この崩壊はゆっくりとしたプロセスでエネルギーを放出します。
約5,730年後、開始時の$^{14}$C濃度の半分が$^{14}$Nに戻ります。同位体の元の濃度の半分がより安定な形に崩壊するのにかかる時間を、その半減期 (half-life) と呼びます。$^{14}$Cの半減期は長いため、科学者はそれを使って、古い骨や木材のような、かつて生きていた物体の年代を測定します。物体中の$^{14}$C濃度と大気中の$^{14}$Cの量の比率を比較することにより、科学者はまだ崩壊していない同位体の量を決定できます。この量に基づいて、図2.4が示すように、もしそれが約50,000年よりもそれほど古くなければ、ピグミーマンモスのような物質の年代を正確に計算することができます。他の元素には異なる半減期を持つ同位体があります。たとえば、$^{40}$K(カリウム40)の半減期は12.5億年であり、$^{235}$U(ウラン235)の半減期は約7億年です。放射年代測定法を使用することにより、科学者は化石や絶滅した生物の他の遺物の年代を研究し、生物が以前の種からどのように進化したかを理解することができます。

学びへのリンク
原子、同位体、そして同位体を互いに区別する方法についてもっと学ぶために、シミュレーションを実行してください。
周期表
周期表 (periodic table) は、異なる元素を整理し、表示します。1869年にロシアの化学者ドミトリ・メンデレーエフ (Dmitri Mendeleev, 1834–1907) によって考案されたこの表は、ユニークでありながら他の元素と特定の化学的性質を共有する元素をグループ化しています。元素の性質は、室温での物理的状態(気体、固体、または液体)に関与しています。元素はまた、特定の化学反応性 (chemical reactivity)、すなわち互いに結合し、化学的に結合する能力を持っています。
図2.5の周期表では、元素はその原子番号に従って整理され、共有される化学的および物理的性質に基づいて一連の行と列に配置されています。各元素の原子番号を提供することに加えて、周期表は元素の原子量も表示します。例えば炭素を見ると、その記号(C)と名前が現れ、原子番号6(左上隅)と原子量12.01も表示されています。

周期表は化学的性質に従って元素をグループ化します。科学者は、元素間の化学反応性の違いを、原子の電子の数と空間分布に基づいています。化学的に反応し、互いに結合する原子は分子 (molecule) を形成します。分子は、単に2つ以上の原子が化学的に結合したものです。論理的に、2つの原子が化学的に結合して分子を形成するとき、各原子の最外領域を形成する電子が、原子が化学結合 (chemical bond) を形成するときに最初に集まります。
電子殻とボーアモデル
元素中の陽子の数、元素を互いに区別する原子番号、そしてそれが持つ電子の数との間に関連があることに注意してください。すべての電気的に中性の原子では、電子の数は陽子の数と同じです。したがって、各元素は、少なくとも電気的に中性である場合、その原子番号に等しい特徴的な数の電子を持っています。
1913年、デンマークの科学者ニールス・ボーア (Niels Bohr, 1885–1962) は原子の初期モデルを開発しました。ボーアモデルは、原子を中心核(陽子と中性子を含む)として示し、電子は原子核から特定の距離にある円軌道上にあります(図2.6参照)。これらの軌道は電子殻 (electron shell) またはエネルギー準位 (energy level) を形成し、これは最外殻の電子数を視覚化する方法です。これらのエネルギー準位は数字と記号「n」で指定されます。たとえば、1nは原子核に最も近い最初のエネルギー準位を表します。
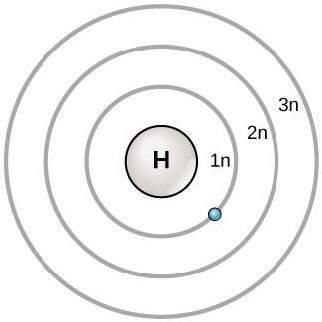
電子は一貫した順序で軌道を埋めます。まず原子核に最も近い軌道を埋め、次に原子核からさらに遠いエネルギーが増加する軌道を埋め続けます。等しいエネルギーの複数の軌道がある場合、それらは2番目の電子を追加する前に、各エネルギー準位に1つの電子で満たされます。最外エネルギー準位の電子は、原子のエネルギー的安定性と、他の原子と化学結合を形成して分子を形成する傾向を決定します。
標準条件下では、原子はまず内側の殻を埋め、しばしば最外殻に可変数の電子が残ります。最内殻には最大2つの電子がありますが、次の2つの電子殻はそれぞれ最大8つの電子を持つことができます。これはオクテット則 (octet rule) として知られており、最内殻を除いて、原子はその最外殻 (valence shell)(最も外側の電子殻)に8つの電子を持つとき、エネルギー的により安定であると述べています。図2.7は、いくつかの中性原子とその電子配置の例を示しています。図2.7では、ヘリウムが完全な外側電子殻を持ち、その最初で唯一の殻を2つの電子で満たしていることに注目してください。同様に、ネオンは8つの電子を含む完全な外側の2n殻を持っています。対照的に、塩素とナトリウムは外殻にそれぞれ7つと1つの電子を持っていますが、理論的にはオクテット則に従って8つ持っていれば、よりエネルギー的に安定するでしょう。
図を見て考えよう 2.7
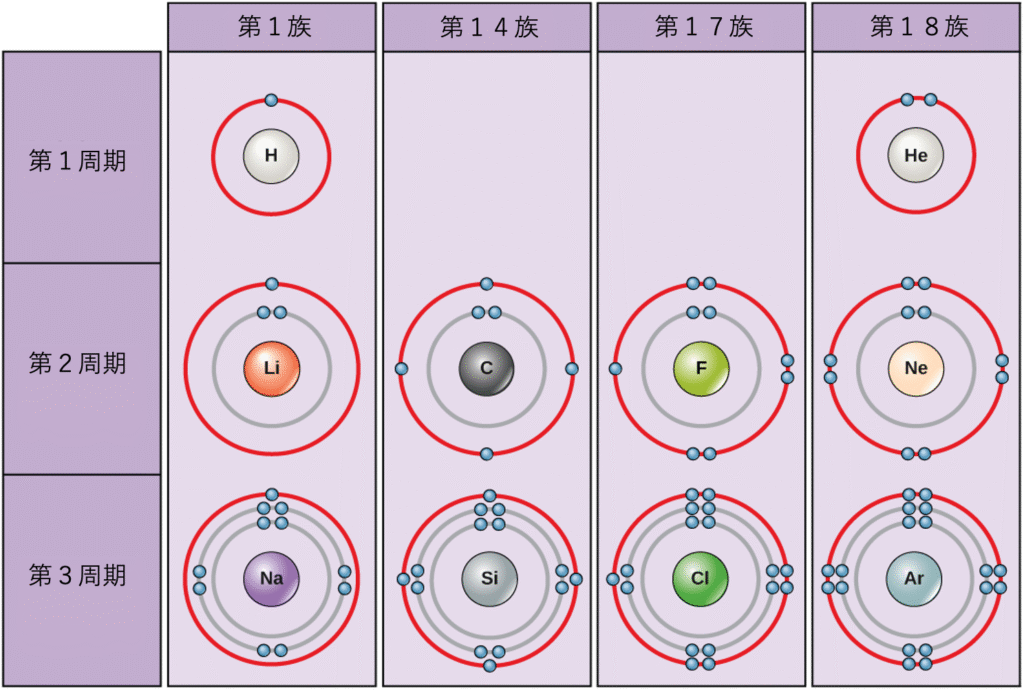
原子は、完全な価電子殻、つまり最も安定した電子配置を達成するために、他の原子と電子を与えたり、受け取ったり、共有したりすることがあります。この図を見て、第1族の元素が安定した電子配置を達成するためには、いくつの電子を失う必要がありますか?第14族と第17族の元素が安定した配置を達成するためには、いくつの電子を獲得する必要がありますか?
(解答は2.1節末に記載)
周期表の構成が陽子(および電子)の総数に基づいていることを理解することは、電子がどのように殻の間で分配されるかを知るのに役立ちます。周期表は、電子の数とその位置に基づいて列と行に配置されています。図2.5の表の右端の列にある元素のいくつかを詳しく調べてみましょう。第18族原子のヘリウム(He)、ネオン(Ne)、アルゴン(Ar)はすべて、満たされた外側電子殻を持っており、安定性を達成するために他の原子と電子を共有する必要がありません。それらは単一原子として非常に安定しています。反応しないため、科学者はそれらを不活性ガス (inert gas)(または希ガス (noble gas))と呼びます。これを左側の列の第1族元素と比較してください。これらの元素(水素(H)、リチウム(Li)、ナトリウム(Na)を含む)はすべて、最外殻に1つの電子を持っています。これは、他の原子や水のような分子と1つの電子を供与または共有することによって、安定した配置と満たされた外殻を達成できることを意味します。水素はこの配置を達成するために電子を供与または共有しますが、リチウムとナトリウムは電子を供与して安定になります。負に帯電した電子を失った結果、それらは正に帯電したイオン (ion) になります。フッ素や塩素を含む第17族元素は、最外殻に7つの電子を持っているため、他の原子や分子からの電子でこの殻を満たす傾向があり、負に帯電したイオンになります。炭素が生命システムにとって最も重要である第14族元素は、外殻に4つの電子を持っており、他の原子といくつかの共有結合(後述)を形成することができます。したがって、周期表の列は、これらの元素の類似した化学的特性の原因である外側電子殻の潜在的な共有状態を表しています。
電子軌道
特定の元素の反応性と化学結合を説明するのに役立ちますが、ボーアモデルは、電子が原子核の周りに空間的にどのように分布しているかを正確に反映していません。それらは地球が太陽を周回するように原子核を周回するのではなく、電子軌道 (electron orbital) の中に見られます。これらの比較的複雑な形状は、電子が粒子としてだけでなく、波としても振る舞うという事実から生じます。科学者が波動関数と呼ぶ量子力学 (quantum mechanics) の数学方程式は、特定の確率レベル内で、電子がいつでもどこにある可能性があるかを予測できます。科学者は、電子が最も見つかる可能性が高い領域をその軌道と呼びます。
ボーアモデルが原子の電子殻配置を描写することを思い出してください。各電子殻内には副殻があり、各副殻には電子を含む指定された数の軌道があります。電子の位置を正確に計算することは不可能ですが、科学者はそれがその軌道経路内に最も存在する可能性が高いことを知っています。文字s、p、d、およびfが副殻を指定します。s副殻は球形で、1つの軌道を持っています。主殻1nには単一のs軌道しかなく、2つの電子を保持できます。主殻2nには1つのs副殻と1つのp副殻があり、合計8つの電子を保持できます。p副殻には、図2.8が示すように、3つのダンベル型の軌道があります。dおよびf副殻はより複雑な形状を持ち、それぞれ5つおよび7つの軌道を含んでいます。これらは図には示されていません。主殻3nにはs、p、およびd副殻があり、18個の電子を保持できます。主殻4nにはs、p、d、およびf軌道があり、32個の電子を保持できます。原子核から離れるにつれて、エネルギー準位内の電子と軌道の数が増加します。周期表で原子から次の原子へと進むにつれて、次の利用可能な軌道に追加の電子を適合させることによって電子構造を決定できます。
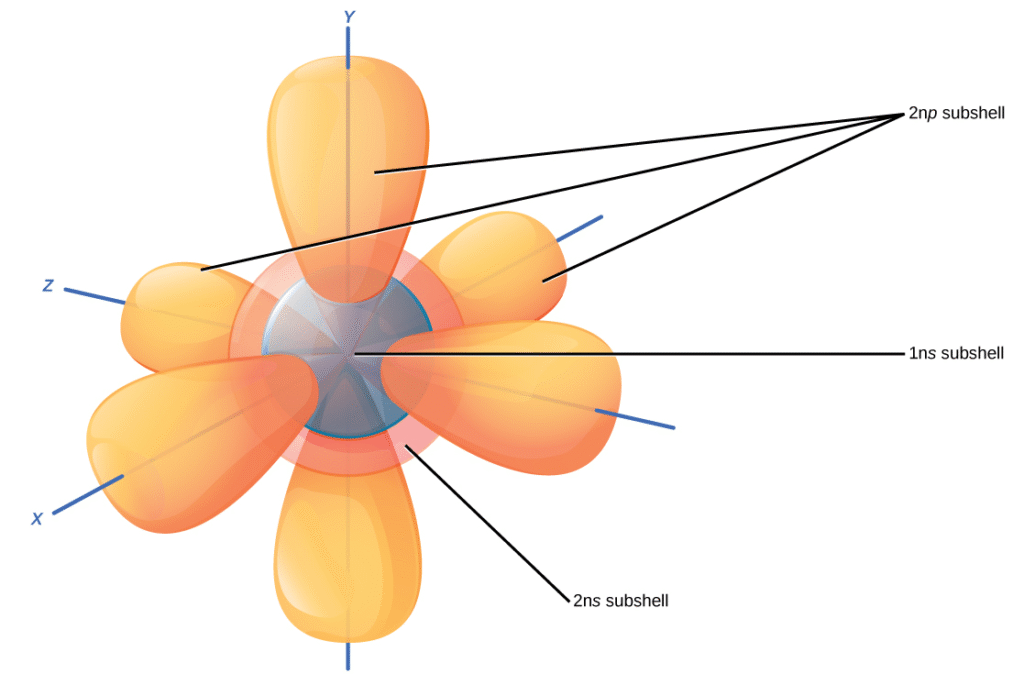
原子核に最も近い軌道である1s軌道は、最大2つの電子を保持できます。この軌道は、ボーアモデルの最も内側の電子殻と同等です。科学者は、それが原子核の周りで球形であるため、それを1s軌道と呼びます。1s軌道は原子核に最も近い軌道であり、他の軌道が満たされる前に常に最初に満たされます。水素は1つの電子を持っています。したがって、1s軌道内の1つの場所しか占有しません。これを$1s^1$と指定します。ここで、上付きの1は1s軌道内の1つの電子を指します。ヘリウムは2つの電子を持っています。したがって、その2つの電子で1s軌道を完全に満たすことができます。これを$1s^2$と指定し、1s軌道内のヘリウムの2つの電子を指します。周期表図2.5では、水素とヘリウムは最初の行(周期)にある唯一の2つの元素です。これは、それらが最初の殻、つまり1s軌道にしか電子を持たないためです。水素とヘリウムは、電気的に中性の状態で1sを持ち、他の電子軌道を持たない唯一の2つの元素です。
2番目の電子殻には8つの電子が含まれる場合があります。この殻には、別の球形のs軌道と、それぞれが2つの電子を保持できる3つの「ダンベル」型のp軌道が含まれています(図2.8参照)。1s軌道が満たされた後、2番目の電子殻が満たされ、まず2s軌道、次に3つのp軌道が満たされます。p軌道を埋めるとき、それぞれが単一の電子を取ります。各p軌道に電子があると、2番目の電子を追加できます。リチウム(Li)には、最初と2番目の殻を占める3つの電子が含まれています。2つの電子が1s軌道を埋め、3番目の電子が次に2s軌道を埋めます。その電子配置は$1s^2 2s^1$です。一方、ネオン(Ne)には合計10個の電子があります。2つは最も内側の1s軌道にあり、8つは2番目の殻(2s軌道と3つのp軌道にそれぞれ2つずつ)を満たします。したがって、それは不活性ガスであり、他の原子と化学結合を形成することはめったにない単一原子としてエネルギー的に安定しています。より大きな元素には追加の軌道があり、3番目の電子殻を構成します。電子殻と軌道の概念は密接に関連していますが、軌道モデルは、電子が占有する可能性のあるすべての場所の異なる形状と特別な向きを指定するため、原子の電子配置をより正確に描写します。
学びへのリンク
この視覚的なアニメーションを見て、p軌道とs軌道の空間的配置を確認してください。
化学反応と分子
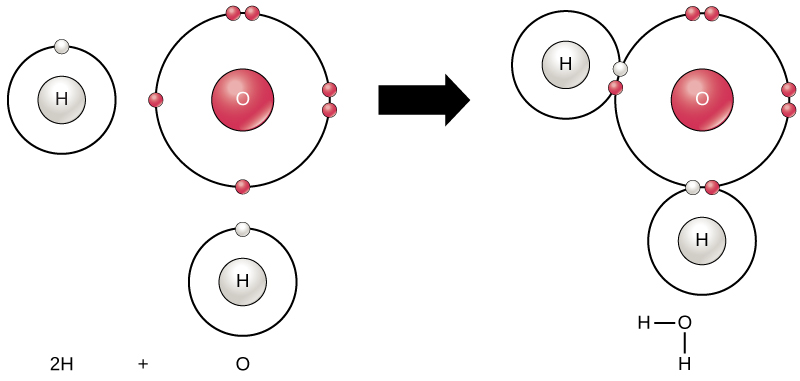
すべての元素は、オクテット則に従って最外殻が電子で満たされているときに最も安定しています。これは、原子がその配置にあることがエネルギー的に有利であり、それが原子を安定させるためです。しかし、すべての元素が最外殻を満たすのに十分な電子を持っているわけではないため、原子は他の原子と化学結合 (chemical bond) を形成し、それによって安定した電子配置を達成するために必要な電子を獲得します。2つ以上の原子が互いに化学的に結合すると、結果として生じる化学構造が分子 (molecule) です。よく知られている水分子H$_2$Oは、2つの水素原子と1つの酸素原子で構成されています。これらは結合して水を形成します(図2.9参照)。原子は、外殻を満たすために電子を供与、受容、または共有することによって分子を形成できます。
化学反応 (chemical reaction) は、2つ以上の原子が結合して分子を形成するとき、または結合した原子が分解するときに起こります。科学者は、化学反応の開始時に使用される物質を反応物 (reactant)(通常、化学方程式の左側)と呼び、反応の終わりにある物質を生成物 (product)(通常、化学方程式の右側)と呼びます。通常、反応物と生成物の間に矢印を描き、化学反応の方向を示します。この方向は必ずしも「一方通行」ではありません。上記の水分子を作成するには、化学方程式は次のようになります:
$2\text{H}_2 + \text{O}_2 \rightarrow 2\text{H}_2\text{O}$
単純な化学反応の一例は、過酸化水素分子の分解です。各分子は2つの水素原子が2つの酸素原子に結合しています(H$_2$O$_2$)。反応物である過酸化水素は、1つの酸素原子が2つの水素原子に結合した水(H$_2$O)と、2つの結合した酸素原子で構成される酸素(O$_2$)に分解されます。以下の式では、反応には2つの過酸化水素分子と2つの水分子が含まれています。これは、平衡化学方程式 (balanced chemical equation) の一例であり、各元素の原子数が方程式の両辺で同じになっています。質量保存の法則によれば、化学反応の前後の原子数は等しくなければならず、通常の状況下では原子が生成されたり破壊されたりすることはありません。
$2\text{H}_2\text{O}_2 \rightarrow 2\text{H}_2\text{O} + \text{O}_2$
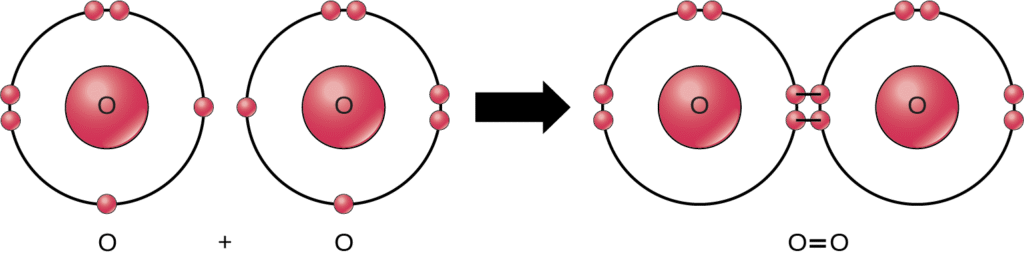
この反応の反応物と生成物のすべてが分子(各原子は少なくとも他の1つの原子に結合したまま)であるにもかかわらず、この反応では過酸化水素と水のみが化合物 (compound) の代表例です。それらは複数の種類の元素の原子を含んでいます。一方、分子状酸素は、図2.10が示すように、二重結合した2つの酸素原子で構成されており、化合物としては分類されず、同核分子として分類されます。
上記のような一部の化学反応は、すべての反応物が消費されるまで一方向に進むことができます。これらの反応を記述する方程式は、一方向の矢印を含み、不可逆反応 (irreversible chemical reaction) です。可逆反応 (reversible chemical reaction) は、どちらの方向にも進むことができる反応です。可逆反応では、反応物が生成物に変わりますが、生成物の濃度が特定の閾値(特定の反応に特徴的)を超えると、これらの生成物の一部が反応物に戻ります。この時点で、生成物と反応物の指定が逆転します。この行き来は、反応物と生成物の間の特定の相対的なバランス、つまり平衡 (equilibrium) と呼ばれる状態が発生するまで続きます。反応物と生成物の両方を指す二重矢印を持つ化学方程式は、しばしばこれらの可逆反応状況を示します。
たとえば、人間の血液中では、過剰な水素イオン(H$^+$)が重炭酸イオン(HCO$_3^-$)に結合し、炭酸(H$_2$CO$_3$)との平衡状態を形成します。この系に炭酸を加えると、その一部が重炭酸イオンと水素イオンに変換されます。
$\text{HCO}_3^- + \text{H}^+ \leftrightarrow \text{H}_2\text{CO}_3$
しかし、生物学的反応が平衡に達することはめったにありません。なぜなら、反応物または生成物またはその両方の濃度が絶えず変化しており、しばしばある反応の生成物が別の反応の反応物となるからです。血液中の過剰な水素イオンの例に戻ると、炭酸の形成が反応の主要な方向になります。しかし、炭酸は重炭酸イオンに戻る代わりに、二酸化炭素ガスとして(呼気を通じて)体外に出ることもでき、したがって質量作用の法則によって反応を右に駆動します。これらの反応は、私たちの血液中の恒常性を維持するために重要です。
イオンとイオン結合
一部の原子は、電子を1つ(または場合によっては2つ)獲得または失ってイオン (ion) を形成すると、より安定になります。これにより、最外電子殻が満たされ、エネルギー的により安定になります。電子の数が陽子の数と等しくないため、各イオンは正味の電荷を持ちます。陽イオン (cation) は、電子を失うことによって形成される正イオンです。負イオンは電子を獲得することによって形成され、陰イオン (anion) と呼ばれます。陰イオンは、その元素名で指定され、末尾を「-ide」に変更します。したがって、塩素の陰イオンは塩化物であり、硫黄の陰イオンは硫化物です。
科学者は、ある元素から別の元素へのこの電子の移動を電子移動 (electron transfer) と呼んでいます。図2.11が示すように、ナトリウム(Na)はその外側電子殻に1つの電子しか持っていません。ナトリウムがその1つの電子を供与する方が、外殻を満たすためにさらに7つの電子を受け入れるよりも少ないエネルギーで済みます。ナトリウムが電子を失うと、陽子11個、中性子11個、電子わずか10個を持ち、全体として+1の電荷を持つことになります。これをナトリウムイオンと呼びます。塩素(Cl)は、最低エネルギー状態(基底状態と呼ばれる)では、外殻に7つの電子を持っています。繰り返しになりますが、塩素が1つの電子を獲得する方が、7つを失うよりもエネルギー効率が良いです。したがって、陽子17個、中性子17個、電子18個を持つイオンを生成するために電子を獲得する傾向があり、正味の負(–1)の電荷を与えます。これを塩化物イオンと呼びます。この例では、ナトリウムはその1つの電子を供与して殻を空にし、塩素はその電子を受け入れて殻を満たします。両方のイオンはオクテット則を満たし、完全な最外殻を持っています。電子の数が陽子の数と等しくなくなったため、それぞれがイオンであり、+1(ナトリウム陽イオン)または–1(塩化物陰イオン)の電荷を持っています。これらの取引は通常、同時にしか行われないことに注意してください。ナトリウム原子が電子を失うためには、塩素原子のような適切な受容体の存在下にある必要があります。
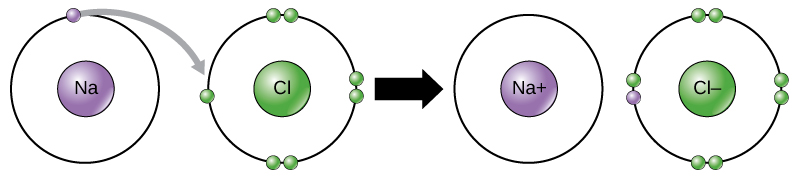
イオン結合 (ionic bond) は、反対の電荷を持つイオン間に形成されます。たとえば、正に帯電したナトリウムイオンと負に帯電した塩化物イオンが結合して、塩化ナトリウム、つまり食卓塩の結晶を作り、正味ゼロ電荷の結晶性分子を生成します。
生理学者は、特定の塩を電解質 (electrolyte)(ナトリウム、カリウム、カルシウムを含む)と呼びます。これは、神経インパルス伝導、筋肉収縮、水分バランスに必要なイオンです。多くのスポーツドリンクや栄養補助食品は、運動中の発汗によって体から失われたこれらのイオンを補給するために提供されます。
共有結合とその他の結合および相互作用
オクテット則を満たす別の方法は、原子間で電子を共有して共有結合 (covalent bond) を形成することです。これらの結合は、生物の分子においてイオン結合よりも強く、はるかに一般的です。共有結合は、私たちのDNAやタンパク質などの炭素ベースの有機分子で一般的に見られます。また、H$_2$O、CO$_2$、O$_2$などの無機分子にも共有結合が見られます。結合は、電子の1対、2対、または3対を共有することがあり、それぞれ単結合、二重結合、三重結合を形成します。2つの原子間の共有結合が多いほど、それらの接続は強くなります。したがって、三重結合が最も強力です。
窒素がその分子を構築するために使用されるのを生物が得るのが困難である主な理由の1つは、共有結合のさまざまなレベルの強さです。分子状窒素N$_2$は大気中で最も豊富なガスであるにもかかわらずです。分子状窒素は、互いに三重結合した2つの窒素原子で構成されており、すべての分子と同様に、これら3対の電子を2つの窒素原子間で共有することで、それらの外側電子殻を満たすことができ、分子を個々の窒素原子よりも安定させます。この強力な三重結合により、生物系がタンパク質やDNAの構成要素として使用するためにこの窒素を分解することが困難になります。
水分子の形成は、共有結合の例を提供します。共有結合は、水分子を形成するために結合する水素原子と酸素原子を結びつけます(図2.9参照)。水素からの電子は、水素原子の不完全な外殻と酸素原子の不完全な外殻の間で時間を分割します。酸素の外殻を完全に満たすためには(6つの電子を持っていますが、8つあればより安定します)、2つの電子(各水素原子から1つ)が必要です。したがって、よく知られている式H$_2$Oが成り立ちます。2つの元素は、それぞれの外殻を満たすために電子を共有し、両方の元素をより安定させます。
学びへのリンク
イオン結合と共有結合のアニメーションを見るには、この短いビデオをご覧ください。
極性共有結合
共有結合には、極性と無極性の2種類があります。極性共有結合 (polar covalent bond) では、図2.12が示すように、原子が電子を不均等に共有し、一方の原子核にもう一方よりも強く引き寄せられます。異なる元素の原子間での不均等な電子分布のため、わずかに正(δ+)またはわずかに負(δ–)の電荷が発生します。この部分電荷は水の重要な特性であり、その多くの特性を説明しています。
水は極性分子であり、水素原子は部分的な正電荷を、酸素は部分的な負電荷を獲得します。これは、酸素原子の原子核が水素原子の電子に、水素原子核が酸素の電子に引き寄せられるよりも強く引き寄せられるために起こります。したがって、酸素は水素よりも高い電気陰性度 (electronegativity) を持ち、共有電子は水素原子の原子核よりも酸素原子核の近くでより多くの時間を過ごし、酸素原子と水素原子にそれぞれわずかに負と正の電荷を与えます。これを別の言い方で表現すると、共有電子が酸素原子核の近くで見つかる確率は、水素原子核の近くで見つかる確率よりも高いということです。いずれにせよ、原子の相対的な電気陰性度は、一方の元素が他方よりも著しく電気陰性度が高い場合に常に部分電荷の発生に寄与し、これらの極性結合が生成する電荷は、その後、反対の部分電荷の引力に基づいて水素結合を形成するために使用される可能性があります。(水素結合は、以下で詳しく説明しますが、ある分子のわずかに正に帯電した水素原子と、他の分子のより電気陰性度の高い原子、通常は酸素との間の弱い結合です。)高分子はしばしば、電気陰性度が異なる原子を内部に持っているため、有機分子には極性結合がしばしば存在します。
無極性共有結合
無極性共有結合 (nonpolar covalent bond) は、同じ元素の2つの原子間、または電子を等しく共有する異なる元素間に形成されます。たとえば、分子状酸素(O$_2$)は、電子が2つの酸素原子間で均等に分布するため、無極性です。
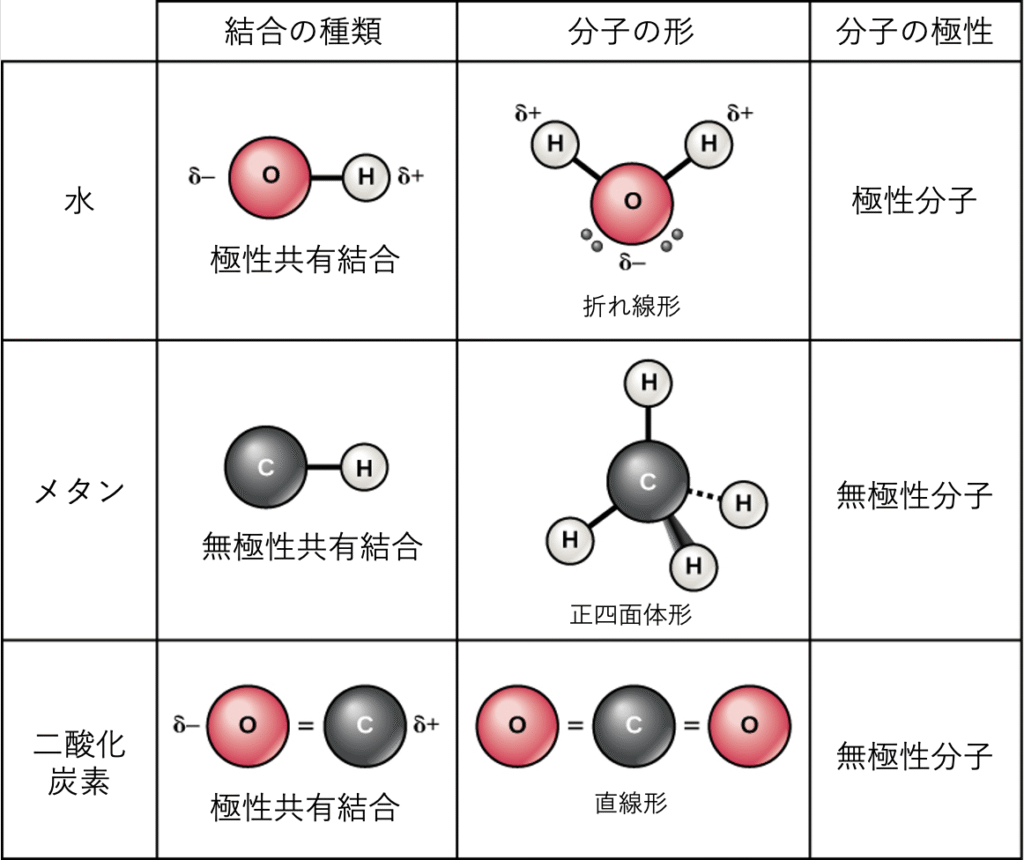
図2.12は、無極性共有結合の別の例、メタン(CH$_4$)も示しています。炭素は最外殻に4つの電子を持ち、それを満たすためにはさらに4つ必要です。それは、それぞれが1つを提供する4つの水素原子からこれら4つを得て、8つの電子の安定した外殻を作ります。炭素と水素は同じ電気陰性度を持っていませんが、類似しています。したがって、無極性結合が形成されます。水素原子はそれぞれ、最外殻に1つの電子を必要とし、2つの電子を含むときに満たされます。これらの元素は、炭素原子と水素原子の間で電子を等しく共有し、無極性共有分子を生成します。
水素結合とファンデルワールス相互作用
元素間のイオン結合と共有結合を壊すにはエネルギーが必要です。イオン結合は共有結合ほど強くなく、これが生物系におけるそれらの振る舞いを決定します。しかし、すべての結合がイオン結合または共有結合であるわけではありません。分子間にはより弱い結合も形成される可能性があります。頻繁に発生する2つの弱い結合は、水素結合 (hydrogen bond) とファンデルワールス相互作用 (Van der Waals interaction) です。これら2種類の結合がなければ、私たちが知っているような生命は存在しないでしょう。水素結合は、水の重要な、生命維持に不可欠な特性の多くを提供し、また、細胞の構成要素であるタンパク質とDNAの構造を安定させます。
水素を含む極性共有結合が形成されると、その結合中の水素はわずかに正の電荷を持ちます。なぜなら、水素の電子は他の元素に向かってより強く引っ張られ、水素から離れるからです。水素はわずかに正であるため、隣接する負電荷に引き寄せられます。これが起こると、ある分子からの水素のδ$^+$と、より電気陰性度の高い原子、通常は酸素を持つ別の分子上の分子のδ$^-$電荷との間に弱い相互作用が発生します。科学者はこの相互作用を水素結合と呼びます。このタイプの結合は一般的であり、水分子間で定期的に発生します。個々の水素結合は弱く、簡単に壊れます。しかし、それらは水や有機ポリマー中に非常に多数存在し、組み合わせることで大きな力を生み出します。水素結合はまた、DNA二重らせんを一緒にジッパーで留める役割も担っています。
水素結合と同様に、ファンデルワールス相互作用は分子間の弱い引力または相互作用です。ファンデルワールス引力は、任意の2つ以上の分子間で発生する可能性があり、常に原子の周りで対称的であるとは限らない電子密度のわずかな変動に依存します。これらの引力が発生するためには、分子が互いに非常に接近している必要があります。これらの結合は、イオン結合、共有結合、水素結合とともに、私たちの細胞内のタンパク質の適切な機能に必要な三次元構造に寄与しています。
キャリアコネクション
薬剤化学者
薬剤化学者は、新しい薬の開発と、古い薬と新しい薬の両方の作用機序の決定を担当しています。彼らは、薬物開発プロセスのすべてのステップに関与しています。薬物は自然環境で見つけることも、実験室で合成することもできます。多くの場合、化学者は、より安全で効果的にするために、自然界の潜在的な薬物を実験室で化学的に変更し、時には合成バージョンの薬物が自然界で見つかるバージョンに取って代わります。
薬物の最初の発見または合成後、化学者は薬物を開発し、おそらく化学的に変更し、有毒かどうかをテストし、効率的な大量生産の方法を設計します。次に、ヒトでの使用のための薬物の承認プロセスが始まります。米国では、食品医薬品局(FDA)が薬物承認を扱います。これには、薬物が有害でなく、意図された状態を効果的に治療することを保証するために、ヒト被験者を使用した一連の大規模な実験が含まれます。このプロセスはしばしば数年かかり、テストを完了し、承認を得るためには、化学者に加えて医師や科学者の参加が必要です。
生きた生物で最初に発見された薬物の一例は、乳がんの治療に使用される抗がん剤であるパクリタキセル(タキソール)です。この薬物は、太平洋イチイの木の樹皮で発見されました。別の例は、もともとヤナギの木の樹皮から分離されたアスピリンです。薬物を見つけることは、しばしば、植物、菌類、その他の生命体の何百ものサンプルをテストして、それらに生物活性化合物が含まれているかどうかを確認することを意味します。時には、伝統医学が現代医学に活性化合物を見つける場所の手がかりを与えることがあります。たとえば、人類は何千年もの間、古代エジプトにまで遡り、薬を作るためにヤナギの樹皮を使用してきました。しかし、科学者や製薬会社がアスピリン分子であるアセチルサリチル酸を精製し、人間の使用のために販売したのは1800年代後半になってからでした。
時折、ある用途のために開発された薬物が、他の無関係な方法で使用できる予期せぬ効果を持つことがあります。たとえば、科学者はもともと高血圧を治療するために薬物ミノキシジル(ロゲイン)を開発しました。ヒトでテストしたとき、研究者は薬物を服用している個人が新しい髪を生やすことに気づきました。最終的に、製薬会社は失われた髪を取り戻すために、脱毛症の男性と女性に薬物を販売しました。
薬剤化学者のキャリアには、探偵作業、実験、薬物開発が含まれる場合があり、すべて人間をより健康にすることを目標としています。
2.1 節末の演習解答
図を見て考えよう 2.3 解答
炭素12 ($^{12}$C) には6個の中性子があります (質量数12 – 陽子数6 = 6)。
炭素13 ($^{13}$C) には7個の中性子があります (質量数13 – 陽子数6 = 7)。
図を見て考えよう 2.7 解答
- 第1族の元素は、安定した電子配置を達成するために1つの電子を失う必要があります。
- 第14族の元素は、安定した配置を達成するために4つの電子を獲得する必要があります。
- 第17族の元素は、安定した配置を達成するために1つの電子を獲得する必要があります。





コメント
[…] […]